摘 要: 为研究二苯胺(DPA)对硝化棉(NC)的等温热分解动力学的影响,采用等温热分解量气装置,获得378.15~398.15 K 时NC/DPA(3%)混合样品热分解产生气体的压力随时间变化曲线,该曲线中存在明显的拐点。通过Arrhenius 方程和模式配合法获得NC/DPA(3%)混合样品在拐点前和拐点后的等温热分解动力学参数。采用Berthelot方程外推得到不同温度下NC/DPA 的贮存寿命。结果表明,拐点前NC/DPA(3%)混合样品的活化能为164.6 kJ·mol-1,拐点后NC/DPA(3%)混合样品的活化能为150.4 kJ·mol-1;与原料NC 相比,拐点前NC/DPA(3%)混合样品的活化能提高17.7 kJ·mol-1;以分解深度0.1%作为评判标准,室温下NC/DPA(3%)混合样品可贮存18.3 年,表明添加3%DPA 后可延长NC 贮存寿命7.7 年。
关键词:硝化棉;二苯胺(DPA);等温热分解;动力学;贮存寿命
1 引言
硝化棉(NC)作为固体推进剂、发射药以及部分混合炸药的主要能量组分[1],其结构中含有大量不稳定的硝酸酯基团,受热易分解,导致NC 基含能材料能量降低、药柱破裂、燃烧甚至爆炸[2-9]。为了抑制NC 的自催化作用,提高其贮存性能,最有效的办法是添加少量弱碱性的化学安定剂,主要包括苯胺、苯脲和酚醚[1]。
传统的安定剂评价方法,如维也里试验、甲基紫试验等,主要通过肉眼观察试纸颜色的变化,进而评判试样的安定性,主观误差大,并且这些方法既不能反映试样热分解的变化过程和趋势,也不能获得热分解的动力学参数[10-11]。非等温测定方法,如热重法、差示扫描量热法和绝热加速量热法等,反映的是试样完全分解的状态[12-13]。而NC 基含能材料在实际贮存过程中通常处于较低的温度,分解缓慢并且长时间处于热分解前期。等温测定方法实验温度相对较低、试样用量大、取样均匀、有代表性,能够反映出含能材料热分解前期的过程[14]。目前,国内外对化学安定剂的研究多关注其热分解动力学[15]。然而,受到研究方法的限制,等温条件下安定剂与NC 的热分解动力学鲜有报道。本课题组肖依依等[16]研制的等温热分解量气装置,可以较长时间自动记录试样热分解过程,获得等温热分解动力学参数,预估试样的贮存寿命,并成功研究了六硝基氮杂异戊兹烷(CL-20)和NC 的等温热分解动力学[17-18]。
二苯胺(DPA),作为一种传统安定剂,已被广泛应用于 NC 基含能材料[1]。目前,关于 DPA 对 NC 的等温热分解动力学研究较少。因此,本研究旨在采用等温热分解量气装置研究DPA 对NC 等温热分解动力学的影响,提出一种可能的定量评价安定剂性能的方法。
2 实验部分
2.1 试剂与仪器
试剂:NC(氮含量12.76%),泸州北方化学工业有限公司;二苯胺,分析纯,上海阿拉丁生化科技股份有限公司;无水乙醇,分析纯,成都科龙化学品有限公司。
仪器:WRT-1D 型热重分析仪(北京光学仪器厂);Q200 型差式扫描量热仪(美国TA 公司)。等温热分解量气装置(自制)[16],该装置能够在线记录数据,实现无人值守;密封效果良好,实验体系数月不漏气,能够进行长时间的热分解实验;金属恒温浴使体系更安全[16]。
2.2 实验过程
2.2.1 NC/DPA 混合样品的制备
采用溶剂混合法制备NC/DPA 混合样品,其中DPA 的质量比为3%。首先选择易挥发的溶剂,该溶剂既对安定剂有很好的溶解性又不溶解NC,本实验选用无水乙醇。准确称取92.78 mg DPA,添加10 mL 无水乙醇,超声溶解,配置浓度为9.28 mg·mL-1的溶液。准确移取1.0 mL 上述溶液,加入装有300.0 mg 干燥NC的专用反应管中,超声使溶液在NC 表面均匀分散。随后,真空干燥至恒重,即得NC/DPA(3%)混合样品。
2.2.2 测试方法
热重分析(TG-DTG):升温速率为10 K· min-1,氮气流动气氛,陶瓷坩埚,试样量约0.5 mg。差示扫描量热仪(DSC):升温速率为 10 K· min-1,氮气流动气氛,铝制样品皿,试样量约为0.5 mg。
等温测试方法如下:(1)设定程序升温,使加热炉恒温在目标温度;(2)将装有NC/DPA 混合样品的专用反应测试管,通过转接头辅以铅O 型圈与压力传感器相连,之后在转接头右侧连接微型真空阀,组成反应测量单元;(3)采用真空机组对反应测量单元抽真空直至压力恒定为0 kPa,然后拧紧微型真空阀,在铅垫的作用下将整个反应测量单元密封;(4)进行气密性实验,设定间隔1 min 采集压力数据,压力恒定在0 kPa 超过24 h,表明反应测量单元不漏气,即密封性良好;(5)将反应测量单元放入已经恒温的加热炉内,在线记录NC 热分解产生的气体压力随时间变化曲线(p-t 曲线)。测试 NC/DPA 混合样品为 300.0 mg,测试 温 度 分 别 为 378.15,383.15,388.15,393.15,398.15 K。在 433.15 K 下进行 10.0 mg NC/DPA 混合样品的热分解实验,直至压力恒定不变,获得NC/DPA完全分解产生的气体总量。
3 数据处理方法
3.1 标准压力的换算
实验在378.15~398.15 K 区间的5 个温度点下进行,连续测定在不同时间内DPA/NC 热分解所产生的气体压力变化,并换算为同一温度下(298.15 K)试样热分解产生的气体压力,得到热分解曲线。换算公式如下:
式中,p0为 298.15 K 时的压力,kPa;pt为某时刻试样热分解产生的气体压力,kPa;T0 为标准状态温度,298.15 K;Tt为实际测试温度,K。
3.2 等温热分解动力学
分解深度(α)为试样在某时刻放出的气体压力值与试样完全分解产生的总气体压力值之比,即:
式中,pt为某时刻试样热分解产生的气体压力值,kPa;p 为试样完全分解产生的气体总压力,kPa。
采用Arrhenius 方程获得等温热分解动力学参数:
式中,t 为反应达到某一分解深度所需要的时间,s;A为指前因子,s-1;Ea为活化能,kJ·mol-1;R 为气体常数,8.314 J·mol-1·K-1;T 为实验温度,K。
对于等温热分解反应,模式配合法[19]应用更为广泛,基本形式如方程(4):
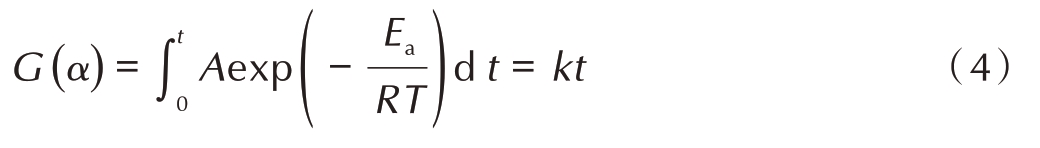
式中,G(α)为关于分解深度α的41种机理函数模型;t为达到某一分解深度所需要的时间,s;A 为指前因子,s-1;Ea为活化能,kJ·mol-1;R 为气体常数,8.314 J·mol-1·K-1;T为实验温度,K;k 为速率常数,s-1。根据方程(4)获得各温度下的最佳机理函数和速率常数k。将各等温下的k值,代入Arrhenius方程:
得到活化能Ea和指前因子A 值。
3.3 贮存寿命
目前寿命预估方程主要有Semenov 法和Berthelot 法[19]。其中,Semenov 法的应用前提是反应级数n=1,Berthelot 法则是不同温度下达到同一分解深度的G(α)形式不变。研究表明,由Berthelot 方程外推获得的寿命小于Semenov 方程,更接近实际寿命[20]。且Berthelot 方程被普遍应用于火药寿命预估领域,在我国的国军标中已被规定为火药寿命预测方法[10]。因此,本研究采用Berthelot 方程外推老化贮存寿命:
式中,T 为温度,K;tT 为贮存时间,s;a 和 b 都为待定系数。
4 结果与讨论
4.1 非等温热分解方法研究DPA对NC热稳定性的影响
NC 和 NC/DPA(3%)的 TG-DTG 和 DSC 曲线如图1 和图2 所示。从 NC 和 NC/DPA(3%)的 TG-DTG和DSC 曲线可以观察到,3% DPA 的加入对NC 非等温热分解影响较小。对于纯的NC,当温度升至450 K时开始分解,分解峰值温度为480.5 K,加入3% 的DPA 后,其热分解失重曲线和放热曲线没有观察到明显变化,其对应的分解峰值温度为481.8 K。可见,非等温测定方法由于升温速率较快很难检测出缓慢的变化。

图1 NC 和 NC/DPA(3%)的 TG-DTG 曲线
Fig.1 TG-DTG curves of NC and NC/DPA(3%)

图2 NC 和 NC/DPA(3%)的 DSC 曲线
Fig.2 DSC curves of NC and NC/DPA(3%)
4.2 等温热分解方法研究DPA对NC热稳定性的影响
采用等温热分解量气装置实时记录NC/DPA 的等温热分解过程,获得NC/DPA 热分解p-t 曲线,见图3。如图3a 所示,在 433.15 K 下,10.0 mg NC/DPA 经过1397 min 分解完全,最终释放气体100.3 kPa。通过换算,300.0 mg NC/DPA 完全分解应放出气体3009.4 kPa。由图3b 可见,NC/DPA 的反应速率随温度的升高而加快,其热分解p-t 曲线中存在明显的拐点,其原因可能是拐点处DPA 消耗完全。
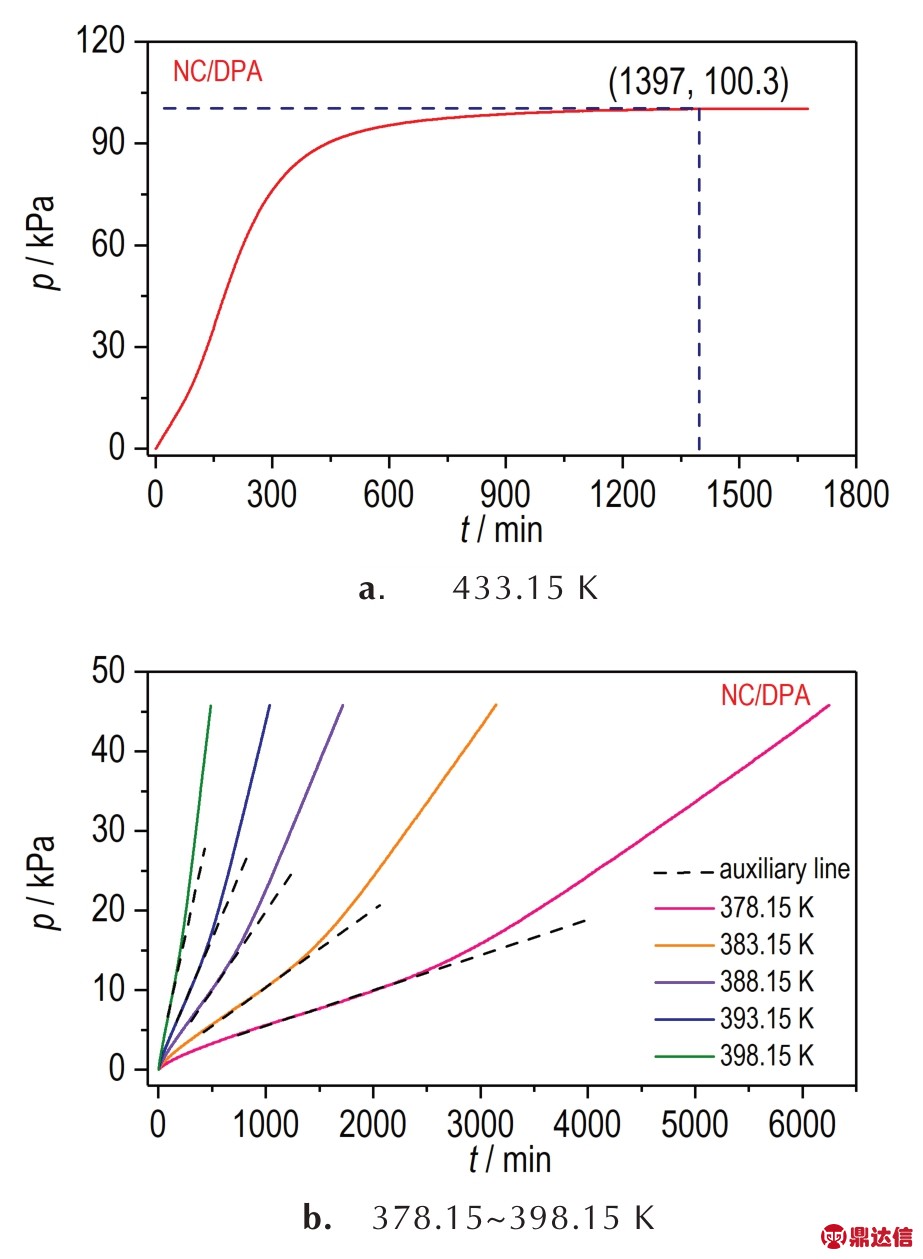
图3 NC/DPA 等温热分解产生的气体压力随时间变化曲线
Fig.3 Gas pressure versus time curves of the thermal decomposition of NC/DPA
为了深入探究DPA 对NC 热分解过程的影响,将NC 和NC/DPA 混合样品热分解p-t 曲线进行对比(见图4)。显然,拐点前 NC/DPA 的 p-t 曲线位于 NC 的p-t 曲线下方,表明NC/DPA 压力增长速度小于NC,即热分解速率小于NC;拐点后NC/DPA 压力增长速度明显变快,热分解速率超过NC 的热分解速率,表明此时 NC/DPA 比 NC 分解更快,DPA 与 NOx 结合后的产物对NC 有加速分解的作用。
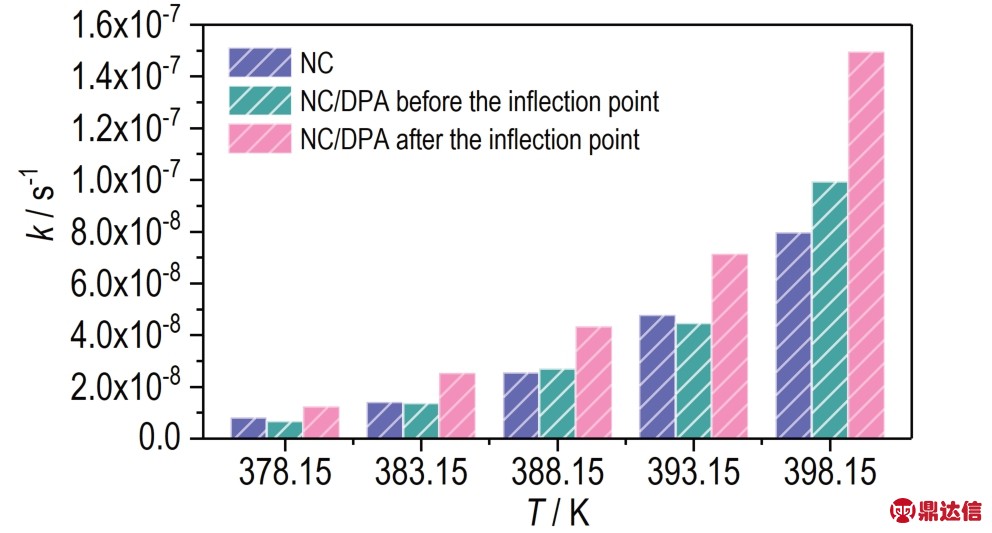
图4 NC 与 NC/DPA 的 p‑t 曲线对比图
Fig.4 Comparison of pressure-time curves of NC and NC/DPA
4.3 DPA对NC等温热分解动力学的影响
根据式(2)从图3b 可得,各温度下 NC/DPA 达到不同分解深度的压力和所需的时间,列于表1 中。可见,随着温度的升高,NC/DPA 热分解至同一分解深度的时间显著增加。符合van′t Hoff 规则,即当温度升高 10 K,反应速率大约增加 2~4 倍[14]。为了探究拐点处的分解深度,根据表1 和图4 作分解深度分布图,如图5 所示,可知拐点处分解深度约为0.5%。
基于 Arrhenius 方程,作 logt-1/T 关系图,如图6 所示,根据拟合方程的斜率和截距分别求得各分解深度下的活化能Ea和指前因子A,结果列于表2 中。与NC的动力学参数相比较,拐点前分解深度0.1%和0.5%时 ,NC/DPA 的活化能分别为 156.7 kJ·mol-1 和162.6 kJ·mol-1,比 NC 的活化能高;拐点后,即分解深度为0.6%时,NC/DPA 的活化能有所下降。
采用模式配合法分别对拐点前和拐点后NC/DPA的动力学进行计算,获得各温度遵循的最佳机理函数及速率常数k,结果列于表3 中。可见,NC/DPA 在各温度下的等温热分解过程依然遵循28 号函数[19],即G(α)=1-(1-α)1/4,这与 NC 的热分解机理函数一致,即DPA 没有改变NC 的热分解机理。对k-T 作图(如图7 所示),拐点前NC/DPA 在各温度下的热分解速率普遍低于NC,而拐点后NC/DPA 的分解速率明显大于NC 的分解速率。基于模式配合法获得各温度下的速率常数k,做lnk-1/T线性拟合,如图8 所示,计算得出拐点前和拐点后NC/DPA 的热分解动力学参数,结果列于表4 中。拐点前分解深度0.1%~0.5% 时,NC/DPA 的活化能分别为 164.6 kJ·mol-1,比 NC 的活化能高;拐点后,即分解深度为0.6%时,NC/DPA 的活化能降低至 150.4 kJ·mol-1。
表1 不同温度下NC/DPA热分解达到不同分解深度所需的时间
Table 1 Time required for NC/DPA thermal decomposition to reach a certain decomposition extent at different temperatures
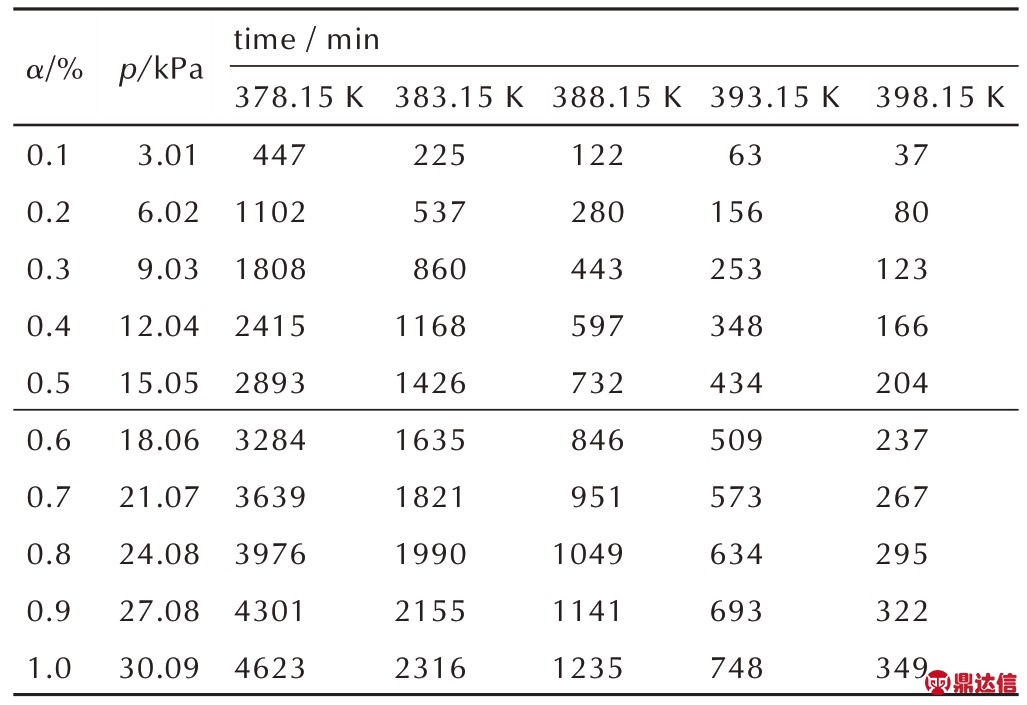
Note: α is decomposition extent.

图5 NC/DPA 的分解深度分布图
Fig.5 Distribution of different decomposition extents of NC/DPA

图6 NC/DPA 的 logt-1/T 关系图
Fig.6 Plots of logt versus 1/T of NC/DPA
表2 基于Arrhenius 方程不同分解深度NC/DPA 的动力学参数
Table 2 Kinetic parameters of NC/DPA at different decomposition extents based on Arrhenius equation

表3 基于模式配合法NC 和NC/DPA 在不同温度下的最佳机理函数及反应速率常数
Table 3 Reaction rate constants and mechanism functions of NC and NC/DPA at different temperatures based on model-fitting method

表4 基于模式配合法NC/DPA 的动力学参数
Table 4 Kinetic parameters of NC/DPA based on model-fitting method


图7 NC 和NC/DPA 的反应数率常数随温度的变化关系
Fig.7 Trend of reaction rate constants of NC and NC/DPA with temperature

图8 NC/DPA 的 lnk-1/T 关系图
Fig.8 Plots of lnk versus 1/T of NC/DPA
在等温热分解前期,即分解深度为0.1%~0.5%,DPA 的加入使活化能升高,分解速率降低;当分解深度为0.6%~1.0%时,NC/DPA 的活化能降低,分解速率明显增加。结合安定剂的作用机制,出现这一现象的原因可能是拐点前NC/DPA 中有DPA 安定剂,可及时吸收NC 分解产生的NOx,从而抑制NC 的自催化反应,使得NC/DPA 分解慢于NC;在拐点后,由于DPA与NOx 结合后的产物对NC 有加速分解的作用,因此在拐点之后分解速率更快。
4.4 DPA对NC贮存寿命的影响
根据Berthelot 方程,拟合logtT 对T 的线性方程,如图9 所示,分别以分解深度0.1%、0.5%作为寿命终点,预估NC/DPA 在不同温度下的贮存寿命,结果列于表5 中。在378.15 K 时,NC/DPA 的有效贮存寿命分别为432 min 和2818 min,与实验测试值447 min、2893 min(表1)相比偏差小于3%。室温下,当分解深度为0.1% 和0.5% 时,NC/DPA 的贮存寿命分别为18.3 年 和 174.3 年 ,与 NC 的贮存寿命 10.6 年 和52.9 年相比[18],大幅度延长。
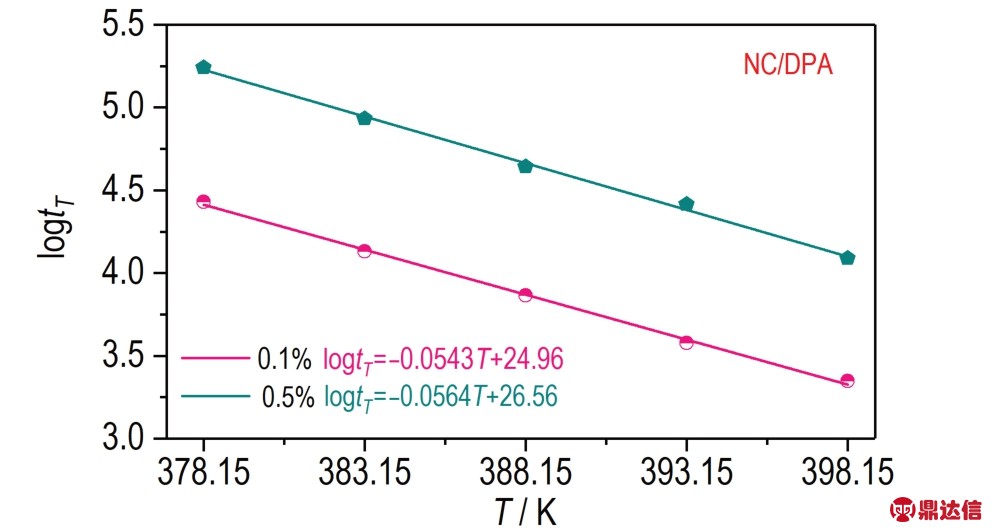
图9 NC/DPA 的 logtT与 T 关系图
Fig.9 Plots of logtT versus T of NC/DPA
表5 不同分解深度下NC/DPA 的经验公式及寿命预估
Table 5 Empirical formulas and life estimation of NC/DPA at different decomposition extents

5 结论
(1)采用等温热分解量气装置研究了NC/DPA 的等温热分解过程,得到不同温度下NC/DPA 热分解释放气体的压力随时间变化曲线,发现曲线上存在明显的拐点。
(2)通过Arrhenius、模式配合法计算拐点前和拐点后的动力学参数。结果表明,拐点前,NC/DPA 的活化能为 164.6 kJ·mol-1,比 NC 的活化能高 17.7 kJ· mol-1;拐点后,NC/DPA 的活化能下降至 150.4 kJ·mol-1。
(3)根据Berthelot 方程计算获得NC/DPA 在各温度下的贮存寿命。室温下,以分解深度0.1%作为寿命终点,加入3%DPA 能够将NC 的贮存寿命延长7.7 年。



