0 引言 Introduction
负压封闭引流技术自20世纪90年代中期德国Fleischmann等[1]首次提出以来,今被广泛应用于治疗难治性伤口、急慢性创伤的创面或创腔及严重感染,是一种加快伤口创面愈合的新型治疗方法。经临床评价研究,负压护创材料效果较佳,现临床用于:①皮肤、软组织感染损伤治疗;②骨科创面治疗;③压疮创面组织;④手术切口脂肪液化堆积治疗等。封闭式负压引流技术能保证有效的引流,加快了创面愈合速度,减少了换药次数,减轻了患者的痛苦,同时还减少了大剂量抗菌药物的应用,缩短了住院时间,减少了住院费用,值得临床推广使用[2-9]。
总的来说,学者们从不同的理论视角对生态文明的定义进行了多方面的阐述。虽然阐述的重点与视角有所不同,但对生态文明的内涵的理解有着基本的一致性。综合参考学界的主要观点,笔者认为,生态文明是指人类在自然和人类社会发展的动态过程中,遵循其客观规律,正确处理人与人、人与自然、人与社会三重关系所取得的一切物质、精神、文化和制度成果,是与物质文明、政治文明、精神文明相并列的一种文明形式,是继原始文明、农业文明和工业文明之后的一种新的文明形态,标志着人类文明发展的新理念、新方向。
“女性主义”也称作“女权主义”,倡导女性觉醒,意识到作为女人在社会中的应有价值是该理论的和谐内涵。从女权主义理论视角,正反两方面去李劼人小说中的人物形象,可以为女人在现实生活中的情感态度取向、话语权争取、婚姻家庭地位等方面给予一定的启示。
为满足临床使用的需要,河南汇博医疗股份有限公司开发了封闭式负压引流护创系统(PU)(型号:PU吸盘型),为验证该产品的安全性和有效性,试验选用材料、结构、适应证相同的重庆清世生物科技有限责任公司生产的封闭式负压引流套件(规格型号:Ⅱ-PU型),采用前瞻性、随机、开放、平行对照的非劣效试验设计,对需实施负压封闭引流操作的患者使用对照产品或试验产品,评估试验产品的有效性及安全性。文章希望对河南汇博医疗股份有限公司开发了封闭式负压引流护创系统(PU)用于患者负压引流的安全性和有效性提供实质性证据,为其临床注册提供依据。
1 对象和方法 Subjects and methods
1.1 设计 前瞻性、随机、开放、平行、对照、非劣效性临床试验。
1.2 时间及地点 于2016年12月至2017年10月在空军军医大学唐都医院烧伤整形科完成。
知识资源的规范化表示包含信息资源的规范化表示和用户需求的规范化表示[11]。复杂工程在建设过程中积累了大量的实践数据,其中包括国际国内标准和行业规范、设计、施工手册以及科学支撑数据等显性知识,也包括工程案例、专家经验及实验与仿真分析数据等隐性知识。面对这些多源异构的信息资源,首要任务就是通过准备、检测和清洗对其进行知识的规范化表示,然后进行主题分类和标引形成具有领域知识属性特征的结构化知识,这是构建面向服务的知识库的基础工作,也是建立与用户需求之间细粒度映射问题匹配的前提条件。
1.3 对象 选择2016年12月至2017年10月在空军军医大学唐都医院烧伤整形科住院的因各种皮肤、软组织创面需进行负压引流的患者。试验于2016-09-13获得空军军医大学唐都医院医学伦理委员会批准,批准号:第201609-10号,所有受试者或其法定代理人均签署了知情同意书。
入选标准[11-30]:自愿参加试验并签署知情同意书;年龄18-75周岁,性别不限;符合负压引流适应证;创面大小为2-150 cm2,具有应用负压引流必须的轮廓;创面周围有应用负压引流必须的完整皮肤;能够与研究者良好交流并遵照试验要求者。
排除标准[11-30]:凝血功能异常者,或有血液疾病史者,或严重出血不止者;严重的低蛋白血症;严重的休克未纠正或并有其他严重的致命性损伤者;恶性肿瘤性创面;坏死组织结痂;非治愈性骨髓炎;非管状和不可探测的瘘管,结核型窦道和溃疡;暴露脉管、神经、吻合部位、骨组织及肌腱;创面有明显的湿性坏疽;干性焦痂创面;创面有已被削弱的缝合的血管;对封闭式负压引流套件过敏者,或对多类药物有过敏史或近期有过敏性疾病者;哺乳期及妊娠期妇女;有精神疾病患者;试验前6个月有乙醇或药物滥用史者;不愿限制活动和不遵医嘱的患者;近3个月内参加过其他临床试验者;研究者认为因其他原因不适宜参加此次临床试验者。
1.4 材料
本刊讯:2018年11月10日,(中国)消费经济学会2018年会暨第二十一次全国消费经济理论与实践研讨会在四川成都隆重召开。为了塑造学会品牌,扩大学会影响力,激发学会活力,打造产学研一体化平台,进一步发挥学会在学科研究和经济社会发展中的积极作用,经(中国)消费经济学会批准,成立(中国)消费经济学会白酒专业研究委员会。中国沈酒集团沈鸿林董事长全票当选(中国)消费经济学会白酒专业研究委员会首届会长。
试验产品:封闭式负压引流护创系统(来源于河南南阳市),规格型号:PU吸盘型,由PU型海绵、医用透明贴膜、吸盘型引流管、冲洗管、冲洗连接管、两通接头、吸引连接管及止流夹组成,该敷料外观为白色或黄色膜片,适用于外伤创面、手术创面及烧烫伤。
对照产品:封闭式负压引流套件(来源于重庆市),规格型号:Ⅱ-PU吸管型, 由医用海绵、透明透气胶贴贴膜、吸引连接管、梯形接头、Y型接头、扁平(或圆形)多孔吸引管及止液夹组成。
当前国有林场对于速生桉树的营造林技术都有一套相应标准的技术手段,为了能够培育更好的林木资源,我们理应在原有的技术手段上,提取手段的优势与不足,对不足之处进行改正,促进速生桉树营造林技术的升级。
1.5 方法
(三)鸡群抗体水平不均衡、不整齐 鸡群中某些个别鸡只可能因为疾病或其他原因造成抗体水平不高,使这部分抗体水平低的鸡在接种前就遭到野毒感染。
1.5.1 试验采用随机对照非劣效试验 以治疗后14 d内的治疗有效率为主要评价指标进行样本量计算。公式如下:![]() P为试验组和对照组预期的14 d内的治疗有效率,δ为非劣效检验界值。假设样本比例为1∶1(试验组和对照组)。治疗后14 d内两组的有效率均为96%,治疗后两组之间的14 d内有效率差值为0,试验组相对于对照组的非劣效性判断界值为-10%,采用单侧检验,检测水准α=0.025,检验效能(1-β)为80%,运用统计分析软件SPSS 20.0估算所需样本量为每组60例,考虑试验中的脱落因素,将脱落率设为10%,最后试验组和对照组的样本量增加至66例,共计132例[31]。
P为试验组和对照组预期的14 d内的治疗有效率,δ为非劣效检验界值。假设样本比例为1∶1(试验组和对照组)。治疗后14 d内两组的有效率均为96%,治疗后两组之间的14 d内有效率差值为0,试验组相对于对照组的非劣效性判断界值为-10%,采用单侧检验,检测水准α=0.025,检验效能(1-β)为80%,运用统计分析软件SPSS 20.0估算所需样本量为每组60例,考虑试验中的脱落因素,将脱落率设为10%,最后试验组和对照组的样本量增加至66例,共计132例[31]。
1.5.2 时间段设置 术前基线筛查(-7至-1 d),至治疗后(10±3)d。
1.5.3 术前基线筛查 签署知情同意书,收集人口学资料,询问病史,完成相关实验室检查、创面评估(患者的创伤严重程度、创面面积、所在部位、创伤时间及创伤原因等)、疼痛评估,审核受试者入选标准与排除标准。筛选合格的受试者须在筛选后7 d内完成随机化进入基线。
1.5.4 随机化、分配隐藏及盲法 病例入选及治疗当天:采用信封法对受试者进行分组隐匿。应用SPSS 20.0统计软件包,按区组随机化的方法产生随机分配表,对签署知情同意书且符合入选/排除标准的受试者,根据入组前后次序打开分配的随机分配信封,在获得随机结果后,研究者在随机分配信件中签署拆阅者姓名和拆阅时间,并根据分配的组别对受试者进行治疗,试验组与对照组患者比例为1∶1。根据随机信件提供的分组情况,按照方案中规定的标准操作流程和使用方法负压引流治疗,记录创面深度、创面面积、负压引流封闭前目测类比评分、首次负压引流开始时间、操作满意度及物理性能,同时记录并发症、合并用药及不良事件。试验未采用盲法分组,但结果指标检测者对试验方案内容不知晓。
1.5.5 负压引流操作步骤 试验组使用封闭式负压引流护创系统(型号:PU吸盘型),对照组选用封闭式负压引流套件(规格型号:Ⅱ-PU型)。两组患者在同一基线水平下入组,根据分组不同采用不同装置进行负压治疗。术后(10±3)d随访,记录创面面积、肉芽生长面积(cm2)、计算肉芽生长率(%),评价肉芽生长情况(优、良、差)、实验室检查、疼痛评分、操作满意度、产品物理性能评价及并发症,记录14 d内治疗有效率,同时记录合并用药、不良事件及严重不良事件。
首先对创面进行清创处理,根据创面大小选择护创材料,用试验组或对照组护创材料填充以尽量保证不留死腔。清洁创面周围皮肤,干纱布擦净皮肤,应用专用贴膜密闭护创材料以防止漏液、漏气,接通负压源进行负压封闭引流。在此过程中,研究者应根据伤口类型及损伤程度的不同调节负压持续或间断吸引,密切观察护创材料的使用情况,根据患者具体情况决定更换护创材料的时间;记录与负压封闭引流相关的并发症。拆除负压引流护创材料后,观察局部皮肤及肉芽组织生长情况。
1.6 主要观察指标
1.6.1 主要疗效结局指标 治疗后14 d内的治疗有效率。治疗有效率=(肉芽组织生长优良总人数/该组病例总例数)×100%。肉芽生长率=(肉芽生长面积/创面总面积)×100%。肉芽生长等级判定(由临床专家根据临床经验制定):优,肉芽生长面积大于85%;良,肉芽生长面积60%-85%;差,肉芽生长面积小于60%。肉芽生长良好标准:肉芽组织表面呈颗粒状、鲜红色,柔软湿润,触之易出血而无痛觉、形似鲜肉。肉芽生长率是计算治疗有效率的一个过程,用来计算肉芽组织生长优良总人数。
中小制造企业需要找到合理的激励方法,因为企业壮大的过程中,需求水平更高的员工,甚至新进人员比老员工薪酬更高的状况,怎样平衡这种差别?最重要的便是打破人才禁锢,采用合适科学的薪酬体制,激励人才。在压缩机械产业中,可以用客观的技术层次评定或者实际业务效果来发放人员薪酬,以能力服人,形成一种上进积极的工作氛围。
1.6.2 次要疗效观察指标 以治疗前和治疗后(10±3)d疼痛评分、操作前后操作满意度和产品物理性能评价作为次要评价指标,评估试验产品的有效性。
疼痛评分:采用目测类比评分法对受试者自觉创面引流部位疼痛症状进行评估[10],在负压引流封闭前、完成负压封闭引流后使用按压法进行评估。
操作满意度:由研究者评价试验产品或对照产品的操作满意度,分为非常满意、满意、一般及不满意4级,并进行组间差异的比较。
产品物理性能评价:分为是(符合以下标准能满足临床应用)和否(不能满足临床应用)两级,并进行组间差异的比较。性能评价指标:①包装生产批号、失效年月标识清晰。包装完整,无破损,热压封口严密,有明显的灭菌标示,便于观察;②器械包装内的配置产品完整、设计合理,能满足临床要求,清洁、无杂质、无异常气味与异物;③引流管在负压吸引后,海绵无干硬、堵塞、引流管通畅无梗阻;引流管与两通接头链接牢固。
1.6.3 安全性评价指标 以不良事件/反应发生率、实验室检查(血常规)、并发症发生率作为安全性指标,评估试验产品的安全性。
不良事件/反应发生率:记录试验中所发生的不良事件(如发热、术中出血、伤口红肿等),并判断是否与试产品相关,同时计算不良事件/反应发生率;不良事件/反应发生率=[(不良事件/反应发生次数)/(试验入组例数)]×100%
教师们受传统教学观念的影响比较重,仍处于相对落后的教学思想中,特别是传统的应试教育在许多学校中教学中根深蒂固,人们一时难以转变教学模式,接受新的教学方法。这就导致了在进行小组合作学习时的效果不佳,难以开展,教师们没有帮助学生们掌握到小组学习的精髓,因此难以达到理想的目标。
实验室检查:入院后,首次进行负压引流前和完成最后1次负压封闭引流并拆除材料后进行血常规(白细胞、中性粒细胞百分比、淋巴细胞百分比、红细胞、血红蛋白、血小板)检查。记录试验组与对照组出现治疗前正常,治疗后异常并有临床意义。
并发症发生率:并发症有高负压引流下出血、医用贴膜下积液、皮损及引流通路堵塞,并发症发生率=(并发症发生次数/入组病例数)×100%。
1.7 统计学分析 采用SPSS 20.0软件进行统计分析。应用全分析数据集(FAS)、符合方案集(PPS)、安全性数据集(SS)为本次研究的治疗有效性(主要疗效及次要疗效)、安全性评估的数据集;有效性分析同时采用FAS和PPS进行分析;安全性评价的主要数据集为SS。定量指标的描述应用统计软件计算最大值、最小值、均数、标准差、四分位数和中位数。定性指标的描述应用统计软件计算各分类的例数及百分数。试验使用的组间统计学方法为成组t 检验、配对t检验、卡方检验/Fisher精确检验、CMH卡方检验,K-W检验,Wilcoxon秩和检验。所有统计检验均采用双侧检验,P<0.05认为差别有显著性意义。
2 结果 Results
2.1 患者数量分析 试验计划入组受试者132例,实际随机132例(试验组66例、对照组66例),所有受试者均完成了方案规定的随访,因此试验的FAS人群为132例(试验组66例及对照组66例),PPS人群128例(试验组65例及对照组63例),SS人群132例(试验组66例及对照组66例)。试验无脱落病例,脱落率为0,符合临床验证方案规定,见图1。
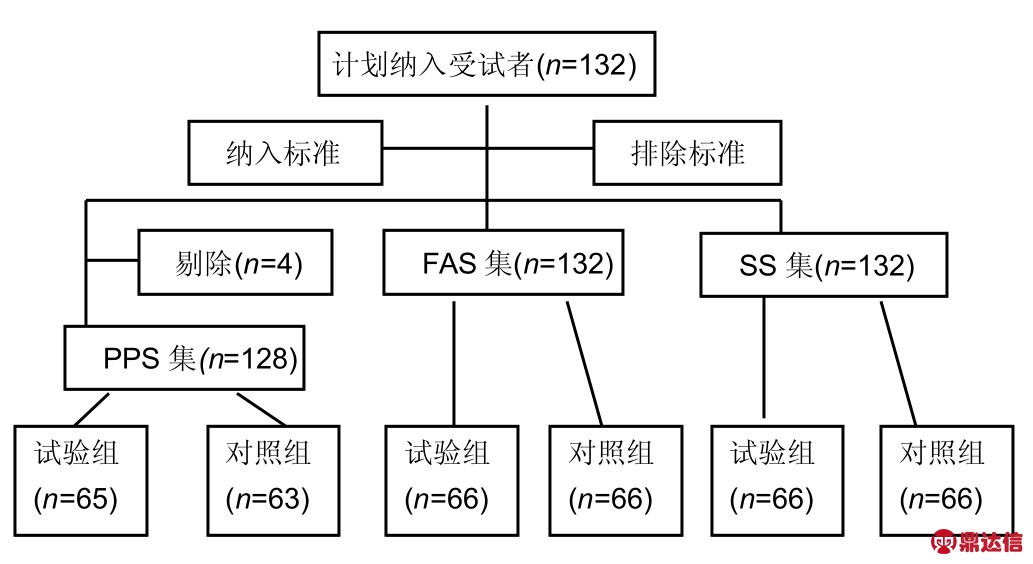
图1 试验分组流程图
Figure 1 Trial flow chart
图注:应用全分析数据集(FAS)、符合方案集(PPS)及安全性数据集(SS)为此次研究的治疗有效性(主要疗效及次要疗效)及安全性评估的数据集。
2.2 受试者基本情况
2.2.1 人口学资料、病史及其他信息 FAS人群中,所有受试者的年龄均在18-75周岁,符合入选标准,两组平均年龄分别为试验组47.06岁、对照组47.70岁。两组受试者基线时在年龄、性别、民族、身高、体质量和基线期实验室检查组间比较差异均无显著性意义(P >0.05);两组创面面积的中位数、25分位值、75分位值分别为试验组(24,9,48)cm2,对照组(20,12,40)cm2。经秩和检验(K-W检验),组间比较差异无显著性意义(P >0.05),基本均衡可比。两组入组时疼痛评分组间比较差异显著(P<0.05)。统计结果显示,各项人口统计学资料及病史特征分布相似,基本均衡可比。详见表1。
2.2.2 基线实验室检查情况 基线时,两组受试者的血常规、肝功能和凝血4项结果,组间比较差异均无显著性意义(P >0.05)。统计结果显示,基线期实验室检查结果基本具有良好的可比性,见表1。
表1 基线期两组受试者的人口资料,受试者创面,实验室比较(FAS)(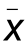 ±s)
±s)
Table 1 Comparison of baseline data,trauma,laboratory indexes between two groups
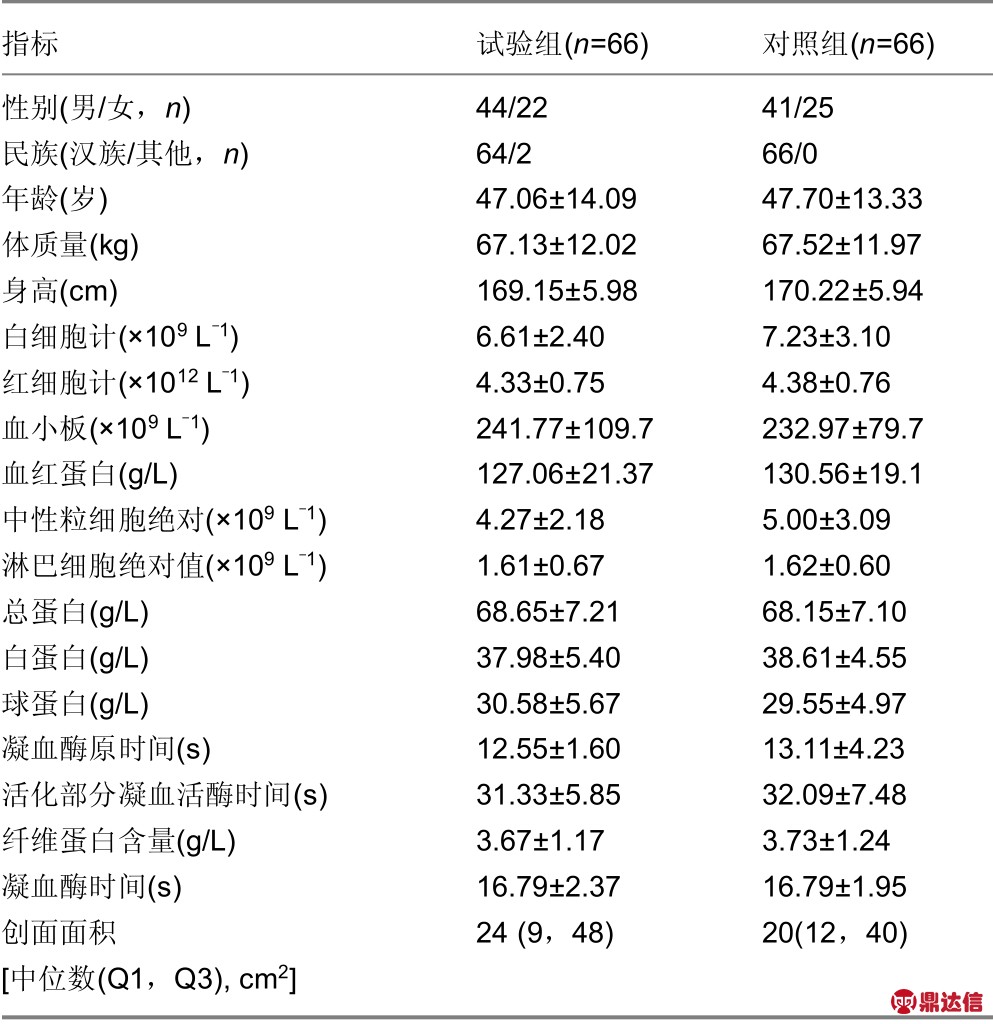
指标 试验组(n=66) 对照组(n=66)性别(男/女,n) 44/22 41/25民族(汉族/其他,n) 64/2 66/0年龄(岁) 47.06±14.09 47.70±13.33体质量(kg) 67.13±12.02 67.52±11.97身高(cm) 169.15±5.98 170.22±5.94白细胞计(×109 L-1) 6.61±2.40 7.23±3.10红细胞计(×1012 L-1) 4.33±0.75 4.38±0.76血小板(×109 L-1) 241.77±109.7 232.97±79.7血红蛋白(g/L) 127.06±21.37 130.56±19.1中性粒细胞绝对(×109 L-1) 4.27±2.18 5.00±3.09淋巴细胞绝对值(×109 L-1) 1.61±0.67 1.62±0.60总蛋白(g/L) 68.65±7.21 68.15±7.10白蛋白(g/L) 37.98±5.40 38.61±4.55球蛋白(g/L) 30.58±5.67 29.55±4.97凝血酶原时间(s) 12.55±1.60 13.11±4.23活化部分凝血活酶时间(s) 31.33±5.85 32.09±7.48纤维蛋白含量(g/L) 3.67±1.17 3.73±1.24凝血酶时间(s) 16.79±2.37 16.79±1.95创面面积[中位数(Q1,Q3),cm2]24 (9,48) 20(12,40)
2.3 疗效评价结果
2.3.1 主要疗效评价结果 治疗后14 d内两组有效率均为试验组100%,差异无显著性意义(P >0.05)。
2.3.2 次要疗效评价结果
治疗前后疼痛评分改善情况比较:两组受试者治疗前和治疗后(10±3)d的疼痛评分见表2。与治疗前相比,试验组和对照组受试者治疗后疼痛评分显著下降,具有统计学差异(P<0.05)。
2015年10月,盛通印刷参股一家从事教育出版策划和发展的公司;2016年4月发布重大资产重组草案,拟用4.3亿元人民币并购少儿机器人教育公司——乐博乐博,致力于4~12岁青少年思维模式及动手能力方面的教育。通过几次参股和并购,盛通印刷悄然完成了业务的大转型,未来的市场格局更加清晰。
表2 两组受试者封闭式负压引流护创系统(PU)使用前后疼痛比较(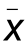 ±s,分)
±s,分)
Table 2 Comparison of the Visual Analog Scale scores between two groups before and after closed negative pressure drainage nursing system (PU suction cup type)

表注:与使用前比较,aP<0.05。
指标 n 使用前目测类比评分 使用后目测类比评分试验组 66 2.61±1.18 1.70±0.97a对照组 66 2.09±0.97 1.60±0.94a
两组产品操作满意度比较:研究者对两组产品操作满意度均为100%,其中非常满意试验组24例,满意42例;对照组非常满意20例,满意46例,操作满意度两组比较差异无显著性意义(P >0.05)。
抛物柱面可展开支撑机构主要由沿着柱面母线方向的纵向肋单元和沿着抛物线方向的横向肋单元组成,横向肋和纵向肋结构相同,通过调整横向斜杆尺寸形成夹角,来拟合抛物线。横向、纵向肋单元组成一个十字模块单元,通过十字单元拓扑即可得到抛物柱面结构(图4)。
两组产品物理性能满足情况比较:试验组与对照组产品在物理性能方面均能100%满足临床需要,其中非常满意试验组24例,满意42例;对照组非常满意20例,满意46例,两组差异无显著性意义(P >0.05)。
2.3.3 安全性评价结果
不良事件及其处理情况:试验按照要求严格记录不良事件的例数、例次和发生率。整个试验期间,66例试验组受试者中有9例(13.6%)发生不良事件,66例对照组受试者中有10例(15.2%)发生不良事件,试验组略低于对照组。
试验组9例不良事件中有1例(发生率1.52%)与试验产品可能有关,为引流管内壁有部分分泌物附着;对照组10例不良事件中有3例(发生率4.5%)与对照产品可能有关,分别为发热、伤口轻度红肿及疼痛,经研究者确认,属产品正常使用情况下可能出现的预期的不良事件,且所有不良事件均未经处理或通对症支持治疗后症状恢复或者减轻,具体见表3。无导致脱落的不良事件发生。以上结果表明,试验产品和对照产品在安全性方面无差异。
表3 不良事件总结表(SS)
Table 3 Summary of adverse events
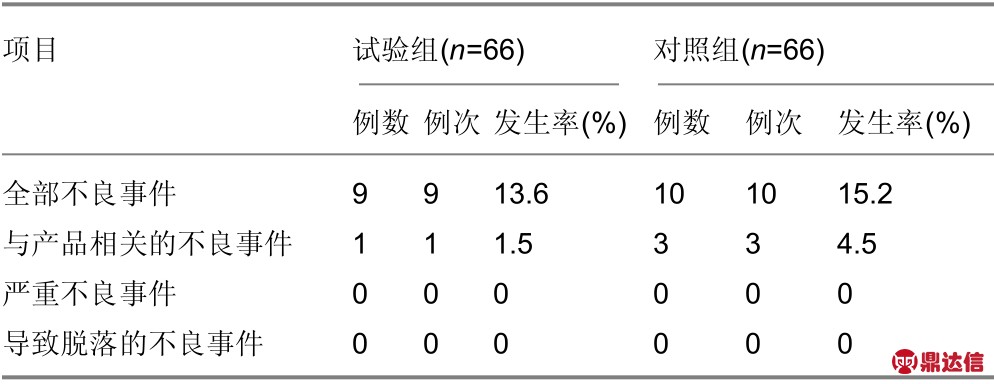
表注:与产品相关:含与产品关系为“肯定有关”“很可能有关”及“可能有关”;导致脱落的不良事件:因该不良事件退出研究的事件。
项目 试验组(n=66) 对照组(n=66)例数 例次 发生率(%) 例数 例次 发生率(%)全部不良事件 9 9 13.6 10 10 15.2与产品相关的不良事件 1 1 1.5 3 3 4.5严重不良事件 0 0 0 0 0 0导致脱落的不良事件 0 0 0 0 0 0
实验室检查结果:试验组与对照组治疗后实验室指标检测结果表明,两组之间差异无显著性意义(P >0.05)。详见表4。
表4 两组受试者治疗后实验室检查比较(SS) ( ±s)
±s)
Table 4 Comparison of laboratory examination after treatment between two groups
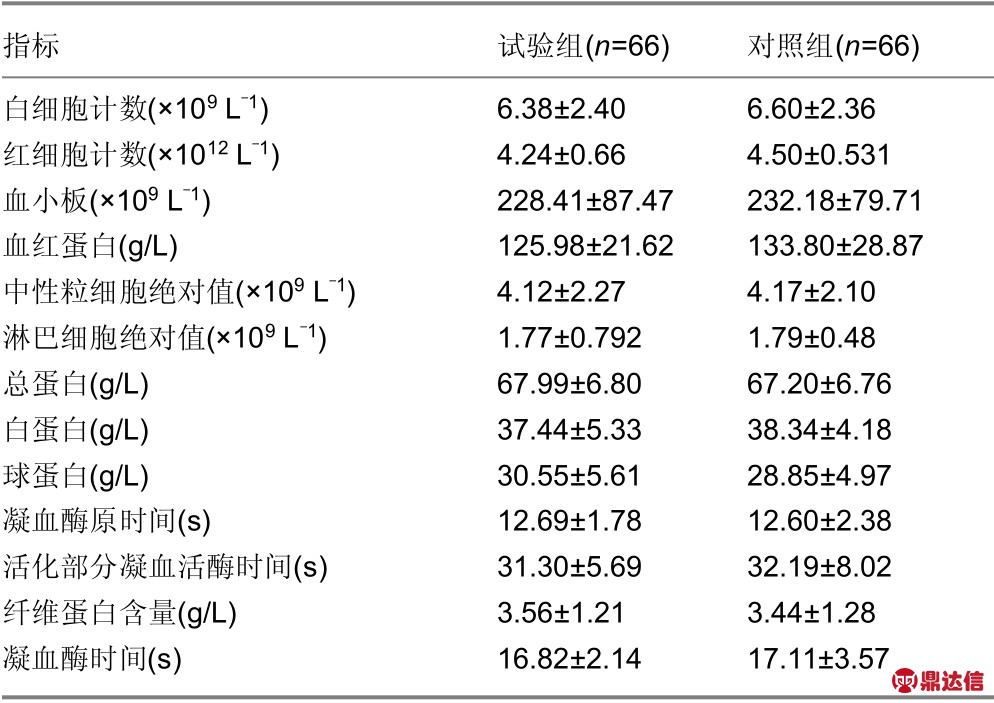
指标 试验组(n=66) 对照组(n=66)白细胞计数(×109 L-1) 6.38±2.40 6.60±2.36红细胞计数(×1012 L-1) 4.24±0.66 4.50±0.531血小板(×109 L-1) 228.41±87.47 232.18±79.71血红蛋白(g/L) 125.98±21.62 133.80±28.87中性粒细胞绝对值(×109 L-1) 4.12±2.27 4.17±2.10淋巴细胞绝对值(×109 L-1) 1.77±0.792 1.79±0.48总蛋白(g/L) 67.99±6.80 67.20±6.76白蛋白(g/L) 37.44±5.33 38.34±4.18球蛋白(g/L) 30.55±5.61 28.85±4.97凝血酶原时间(s) 12.69±1.78 12.60±2.38活化部分凝血活酶时间(s) 31.30±5.69 32.19±8.02纤维蛋白含量(g/L) 3.56±1.21 3.44±1.28凝血酶时间(s) 16.82±2.14 17.11±3.57
并发症及处理:试验中观察记录使用过程中由负压引流系统导致的并发症,包括高负压引流下出血、医用贴膜下积液、皮损及引流通路堵塞等。统计结果表明无并发症发生。试验期间记录合并用药整个试验期间,所有试验组及对照组的受试者均有合并用药,经研究者判断所有的合并用药均不会影响该临床试验的评价结果。
严重不良事件及处理:试验研究过程中未发生严重不良事件,发生率为0。
3 讨论 Discussion
负压封闭引流技术是近年来发展起来的用于创面治疗的一项新技术,其产品更新换代的速度较快。封闭式负压引流护创材料套装属于近年来新研发的产品类型,兼具了早期负压引流产品的所有优点,并在操作便捷性、产品性能等方面做出了较大改进。封闭式负压引流护创材料套装(PU吸盘型)其主要由PU型海绵、医用透明贴膜、吸盘型引流管、冲洗管、冲洗连接管、两通接头、吸引连接管及止流夹组成。PU型海绵主要成分为聚氨基甲酸酯简称聚氨酯,其孔径疏松,柔软而富有弹性,可使伤口部位的负压均匀分布。在负压作用下可压缩至不到一半的体积,引流管不易堵塞,可保持引流管长时间畅通,吸干后海绵不会变硬,主要应用于低负压间歇模式治疗。黑色敷料配合吸盘使用,配置的扁平带冲洗功能吸盘,更有利于临床使用,尤其是背部、臀部及髋部创面患者,不影响患者休息。吸盘管道柔软,不受体位变化影响,方便护理;减少管道连接,方便操作,降低漏气风险;外置吸盘无需贴膜系管,降低了手术时封膜的难度,减少术后漏气风险;单独冲洗连接管,使伤口冲洗加药更加方便卫生,大规格海绵及贴膜设计,降低了操作难度,节省了手术时间。
研究结果证实,河南汇博医疗股份有限公司生产的封闭式负压引流护创系统(PU)能有效促进患者的肉芽生长,使用后14 d治疗有效率高达100%,非劣于对照产品。在疼痛评分、操作满意度及产品物理性能评价这几个方面,试验组产品封闭式负压引流护创系统(PU)与对照产品封闭式负压引流套件的差异均无显著性意义。封闭式负压引流护创系统(PU)在使用过程中未发生高负压引流下出血、医用贴膜下积液、皮损及引流通路堵塞等并发症,也未发生与产品有关的不良事件。此两种产品在正确放置时,均能够提供有效、持续的负压,均可产生良好的引流效果,可抗感染、加速创面愈合,具有减轻患者疼痛、减少换药频次、缩短治疗周期、降低治疗费用的优点。由河南汇博医疗股份有限公司生产的封闭式负压引流护创系统(PU)达到了临床使用安全、有效的要求,可为临床上需要负压引流的患者的治疗提供一种新的选择,试验为其临床注册提供了依据,值得临床推广。
然而当三电平逆变器出现复杂故障时,如出现Sa2、Sc3故障或Sa3、Sc2等故障时,相电压输出波形就比较复杂,不仅造成故障相的输出相电压波形产生畸变,而且非故障相的输出相电压波形也随之发生畸变,在这种情况下就不能仅仅依靠观察输出波形来确定故障具体结果。
此外,高温高湿天气易引发水稻、玉米等作物病虫害,各地要及时做好监测和防治工作。云南等地需采取有效的田间管理措施,防范持续阴雨寡照对粮食作物和经济作物的不利影响。
分析方法则是将不同鱼粉产品的质量指标数据进行统计分析,以总结鱼粉质量评价指标的变化规律、探讨适宜的评价指标种类和指标值,以及筛选判定不同鱼粉产品类型的有效指标等为主要目标和分析方向。旨在探讨判定鱼粉真实质量水平和质量状态的有效指标筛选和合适的指标值。



