摘要:采用水提醇沉、醇提和加热回流等方法对托盘的干燥果实进行提取,对其化学成分及抗氧化活性进行了初步研究。采用紫外可见分光光度法,测定了托盘果中总黄酮、总皂苷、总酚酸、总氨基酸、总多糖的含量,并测定了托盘果醇提取物的体外抗氧化能力。结果表明:托盘果提取物中的总黄酮、总皂苷、总酚酸、总多糖、总氨基酸含量分别为1.31%、0.96%、0.44%、0.55%、1.39%。托盘果醇提物对DPPH、ABTS、超氧阴离子和羟基自由基清除率的IC50值分别为0.087 mg/mL、0.260 mg/mL、2.230 mg/mL、2.120 mg/mL。本试验表明托盘果提取物中含有黄酮类、皂苷类、酚酸类、氨基酸类、多糖类成分,且具有良好的抗氧化活性。
关键词:托盘果;化学成分;抗氧化;总黄酮;总皂苷;总酚酸
0 引言
悬钩子属(Rubus Leveille)是蔷薇科(Rosaceae)蔷薇亚科的一个大属,我国有210余种,该属植物在我国传统中医药中应用十分广泛[1]。托盘 (Rubus crataegifolius Bunge.) 又称牛叠肚,学名为山楂叶悬钩子,为蔷薇科悬钩子属落叶小灌木,是生长于我国的一种野生浆果,广泛分布于东北、华北和中南部地区,现北方部分地区已经通过野生驯化转入人工栽培,其果和根可入药,具有较高药用价值。托盘果味酸、甘,性温,可生食、制果酱或酿酒,具有补肝养肾,缩精固尿的功效。目前,国内外学者对托盘根部化学成分及药理作用的研究较多,而对托盘果的研究较少。托盘根的主要成分包括黄酮类、皂苷类、鞣质类、多糖类和芪类[2-6],且其提取物具有抗氧化、护肝、抗肥胖、降血糖及抗癌等作用[2, 7-11]。研究表明,托盘果含有蛋白质、脂肪酸、碳水化合物、有机酸、维生素及酚类物质等[12]。其功能性成分如黄酮类、皂苷类及多糖类成分的分析及其提取物抗氧化活性研究未见报道。因此,本研究对托盘果的化学成分进行了测定,并测定其醇提取物抗氧化活性,旨在为托盘果进一步开发和利用提供参考依据。
1 材料与方法
1.1 试验材料
托盘果采自吉林市丰满区西郊,经周鸿立教授鉴定为蔷薇科悬钩子属植物托盘的成熟果实。芦丁、齐墩果酸、没食子酸、葡萄糖、DPPH、ABTS:合肥博美生物科技有限公司;L-谷氨酸:北京奥博星生物技术有限公司;维生素C:天津市致远化学试剂有限公司;其他试剂均为分析纯。
1.2 仪器与设备
752 N型紫外可见分光光度计:上海仪电分析仪器有限公司;Spectra Max Plus 384型酶标仪:美国Molecular Devices公司;RE-52AA型旋转蒸发器:上海亚荣生化仪器厂;FD5-2.5型冷冻干燥机:美国金西盟国际集团中国分公司;SHZ-D (III) 型循环水式多用真空泵:郑州市亚荣仪器有限公司;FA-3204B型分析天平:上海天美天平仪器有限公司;HH-4型数显恒温水浴锅:江苏省常州市智博瑞仪器制造有限公司。
1.3 试验方法
1.3.1 托盘果总黄酮、总酚酸提取物的制备
取适量的新鲜托盘果置于60 ℃烘箱中干燥至恒质量,干燥后的托盘果粉碎,过60目筛,称取粉末10 g,置于500 mL圆底烧瓶中,加入80%乙醇200 mL,料液比为1∶20(g/mL)。水浴加热回流提取2次,每次2 h。抽滤后合并滤液,滤液浓缩、冻干,制得浸膏。
1.3.2 总黄酮含量测定方法
参照舒畅等[13]的方法,并稍加改动,以芦丁为标准品绘制标准曲线,得线性回归方程:
A=7.531 3c+0.003 5,R2=0.999 8,
式中:A为吸光度;c为黄酮质量浓度,mg/mL。
样品测定:精确称取上述浸膏0.050 0 g,用80%乙醇溶解后定容至50 mL,配得样品溶液。吸取1 mL样品溶液,置于10 mL容量瓶中,平行3组,按上述方法测量吸光度,计算干浸膏中总黄酮的含量。
1.3.3 总酚酸含量测定方法
参照李春玲[14]的方法,并稍加改动,以没食子酸为标准品绘制标准曲线,得线性回归方程:
A=460.98c-0.034 1,R2=0.999 2,
式中:A为吸光度;c为酚酸质量浓度,mg/mL。
样品测定:吸取上述样品溶液1 mL,置于50 mL容量瓶中,平行3组,按上述方法测量吸光度,计算干浸膏中总酚酸的含量。
1.3.4 托盘果总皂苷提取物的制备
称取托盘果样品粉末10 g,加入70%乙醇200 mL,加热回流提取2 h,提取2次,抽滤后合并滤液,减压浓缩,用70%乙醇定容至50 mL,制得总皂苷提取液。将提取液置于分液漏斗中,加入50 mL水饱和正丁醇,充分振摇,静置30 min,取上层液体。水层继续重复萃取2次,每次25 mL。合并上层溶液,减压浓缩,70 ℃水浴蒸干,制得浸膏。
1.3.5 总皂苷含量测定
参照伊长文等[15]的方法,以齐墩果酸为标准品绘制标准曲线,得线性回归方程:
A=26.163c-0.006,R2=0.999 8,
式中:A为吸光度;c为皂苷质量浓度,mg/mL。
样品测定:将上述浸膏用甲醇溶解,定容至50 mL,配得样品溶液。精确吸取0.1 mL样品溶液于10 mL容量瓶中,平行3组,按上述方法测量吸光度,计算干浸膏中总皂苷含量。
1.3.6 托盘果总氨基酸提取物的制备
称取托盘果样品粉末15 g,置于圆底烧瓶中,加入70%乙醇300 mL,水浴加热回流提取2次,每次2 h。抽滤,合并滤液,浓缩后冷冻干燥,制得浸膏。
1.3.7 总氨基酸含量测定
参照文献[16]的方法,以L-谷氨酸为标准品绘制标准曲线,得线性回归方程:
A=87.657c-0.092 9,R2=0.999 4,
式中:A为吸光度;c为氨基酸质量浓度,mg/mL。
样品测定:精确称取上述浸膏0.050 0 g,用蒸馏水溶解,定容至50 mL,配得样品溶液。吸取总氨基酸溶液1 mL,置于50 mL容量瓶中,平行3组,按上述方法测量吸光度,计算上述干浸膏中总氨基酸的含量。
1.3.8 托盘果总多糖提取物的制备
称取托盘果样品粉末7 g,置于圆底烧瓶中。加入140 mL蒸馏水,95 ℃水浴加热回流提取2次,每次2 h。过滤,合并滤液,经减压浓缩,得总多糖浓缩液。向总多糖浓缩液中加入95%乙醇至乙醇体积分数为80%,放入冰箱中4 ℃静置24 h。抽滤,用80%乙醇洗涤。回收滤饼,干燥至恒质量,制得浸膏。
1.3.9 总多糖含量测定
参照文献[17]的方法,以葡萄糖为标准品绘制标准曲线,得线性回归方程:
A=8.415c+0.177 3,R2=0.999 4,
式中:A为吸光度;c为多糖质量浓度,mg/mL。
将上述浸膏用蒸馏水溶解,定容至50 mL,制得样品溶液。吸取样品溶液0.5 mL于试管中,平行3组,按上述方法测量吸光度,计算上述干浸膏中总多糖的含量。
1.3.10 托盘果醇提取物的抗氧化活性测定
称取干燥粉碎后的托盘果样品15 g,置于500 mL圆底烧瓶中,加入80%乙醇300 mL。水浴加热回流提取2次,每次2 h。抽滤,合并滤液,经减压蒸馏浓缩制成托盘果醇提取物,此提取物用80%乙醇溶解,得样品溶液。
托盘果醇提物体外抗氧化活性采用DPPH[18]、ABTS[19]、超氧阴离子[18]及羟基自由基清除率[20]进行评价。
2 结果与分析
2.1 托盘果提取物中功能性成分含量
采用醇提法提取托盘果总黄酮、总酚酸、总氨基酸,用水提醇沉法提取托盘果总多糖,用溶剂萃取法提取托盘果总皂苷,测定结果见表1。与悬钩子属其他植物果实相比,托盘果中总黄酮含量(1.31%)明显高于覆盆子的总黄酮含量(0.95%)[21]。康琴等[22]选取悬钩子属植物红腺悬钩子,测得其叶片的皂苷含量为1.18%,与本试验中总皂苷含量(0.96%)相近。李春奇等[23]采用与本试验相同的方法对悬钩子属植物插田泡中氨基酸含量进行测定,结果为1.26%,与本试验测定结果(1.39%)相似。和加卫等[24]在对云南省悬钩子属植物药用资源综述中提到,同属的掌叶覆盆子中的总糖含量为3.77%,由此可见,托盘果在悬钩子属植物中多糖含量处于较低水平。
表1 托盘果提取物中功能性成分含量
Table 1 Content of functional components in the extract of R. crataegefolius Bunge. fruits %
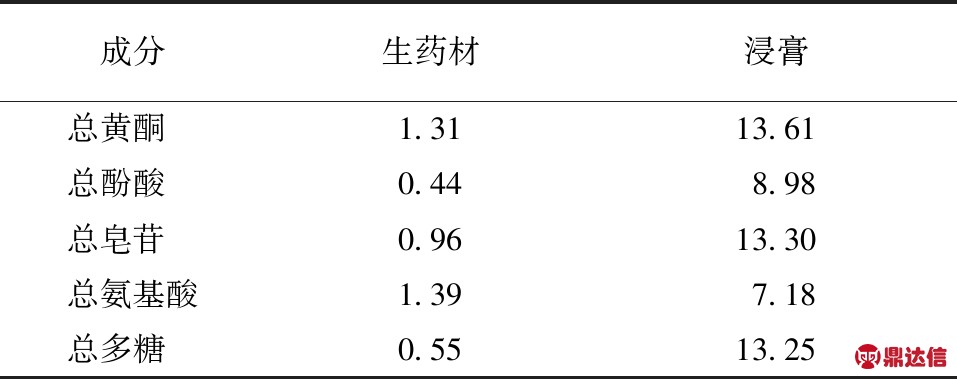
2.2 DPPH自由基清除能力
由图1可知,托盘果醇提取物DPPH清除率在质量浓度范围0.006 25~0.2 mg/mL内具有明显的浓度依赖关系。当质量浓度大于0.2 mg/mL时,DPPH自由基清除率的上升趋势趋于平缓。托盘果醇提取物清除DPPH自由基的IC50值为0.087 mg/mL,VC的IC50值为0.011 mg/mL,说明托盘果醇提取物DPPH自由基清除能力低于VC。试验结果说明,托盘果醇提取物能明显地清除DPPH自由基,具有较强的抗氧化能力。
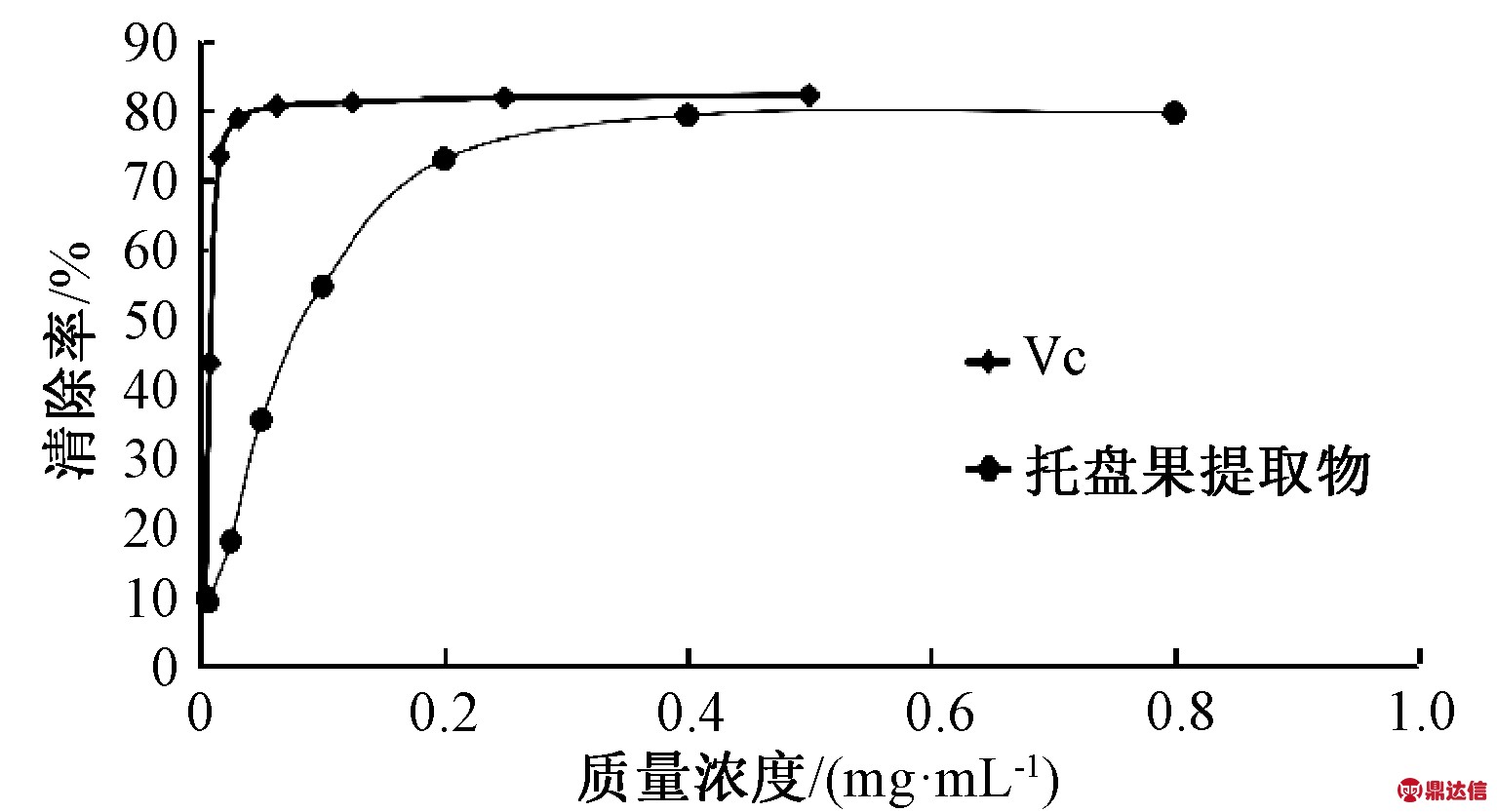
图1 DPPH自由基的清除能力
Fig.1 DPPH free radical scavenging ability
2.3 ABTS自由基清除能力
由图2可知,托盘果醇提取物ABTS自由基清除率在质量浓度范围0.006 25~0.4 mg/mL内具有明显的浓度依赖关系。当质量浓度大于0.4 mg/mL时,ABTS自由基清除率的上升趋势趋于平缓。托盘果醇提取物清除ABTS自由基的IC50值为0.260 mg/mL,VC的IC50值为0.023 mg/mL,说明托盘果醇提取物ABTS自由基清除能力低于VC。试验结果说明,托盘果醇提取物能明显地清除ABTS自由基,具有较强的抗氧化能力。
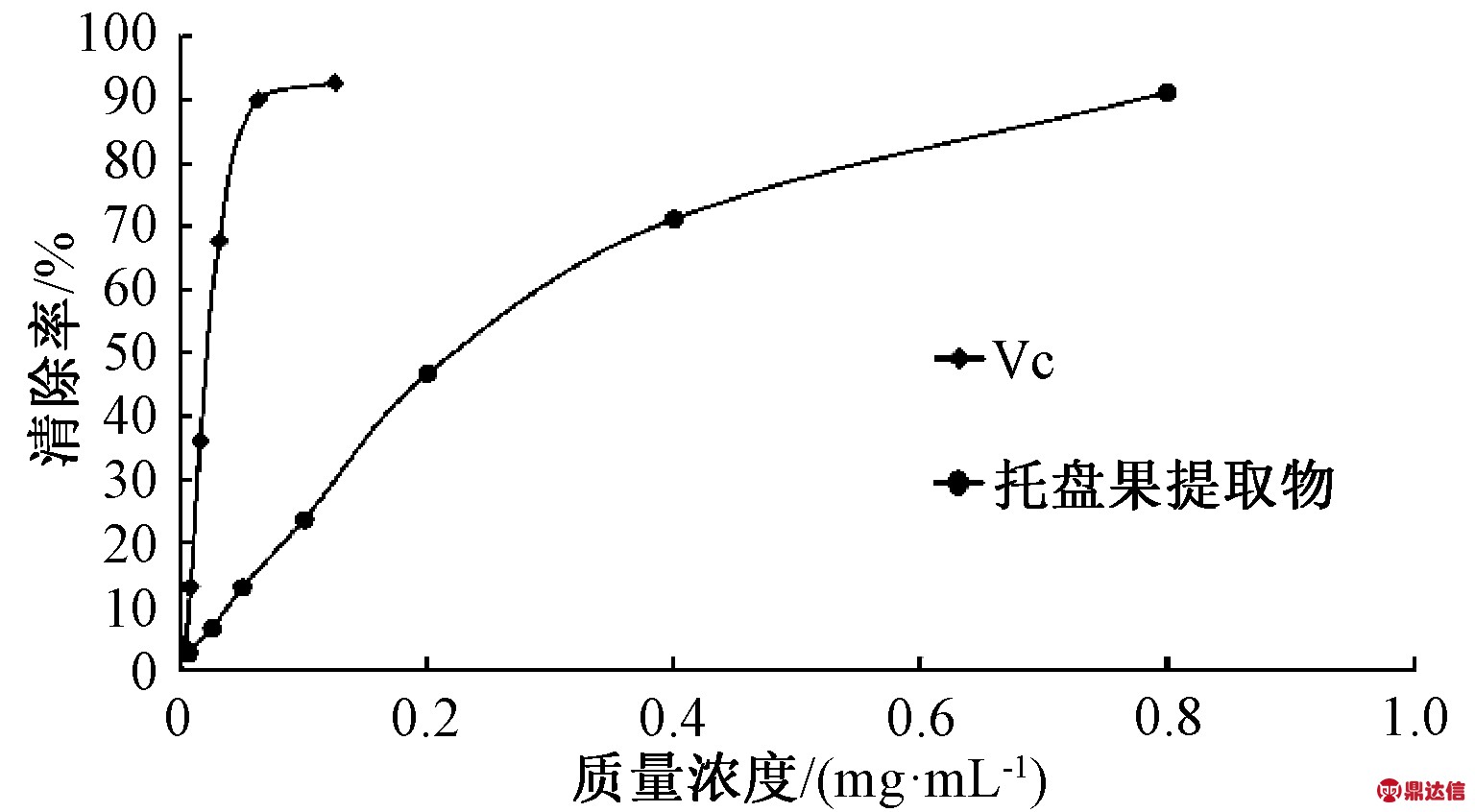
图2 ABTS自由基的清除能力
Fig.2 ABTS free radical scavenging ability
2.4 超氧阴离子自由基清除能力
由图3可知,托盘果醇提取物的超氧阴离子自由基清除率在质量浓度范围0.2~3.2 mg/mL内上升趋势较为平缓,无明显浓度依赖关系。托盘果醇提取物清除超氧阴离子自由基的IC50值为2.230 mg/mL,VC的IC50值为0.300 mg/mL,说明托盘果醇提取物超氧阴离子自由基清除能力低于VC。试验结果说明,托盘果醇提取物能较多地清除超氧阴离子自由基,具有一定的抗氧化能力。
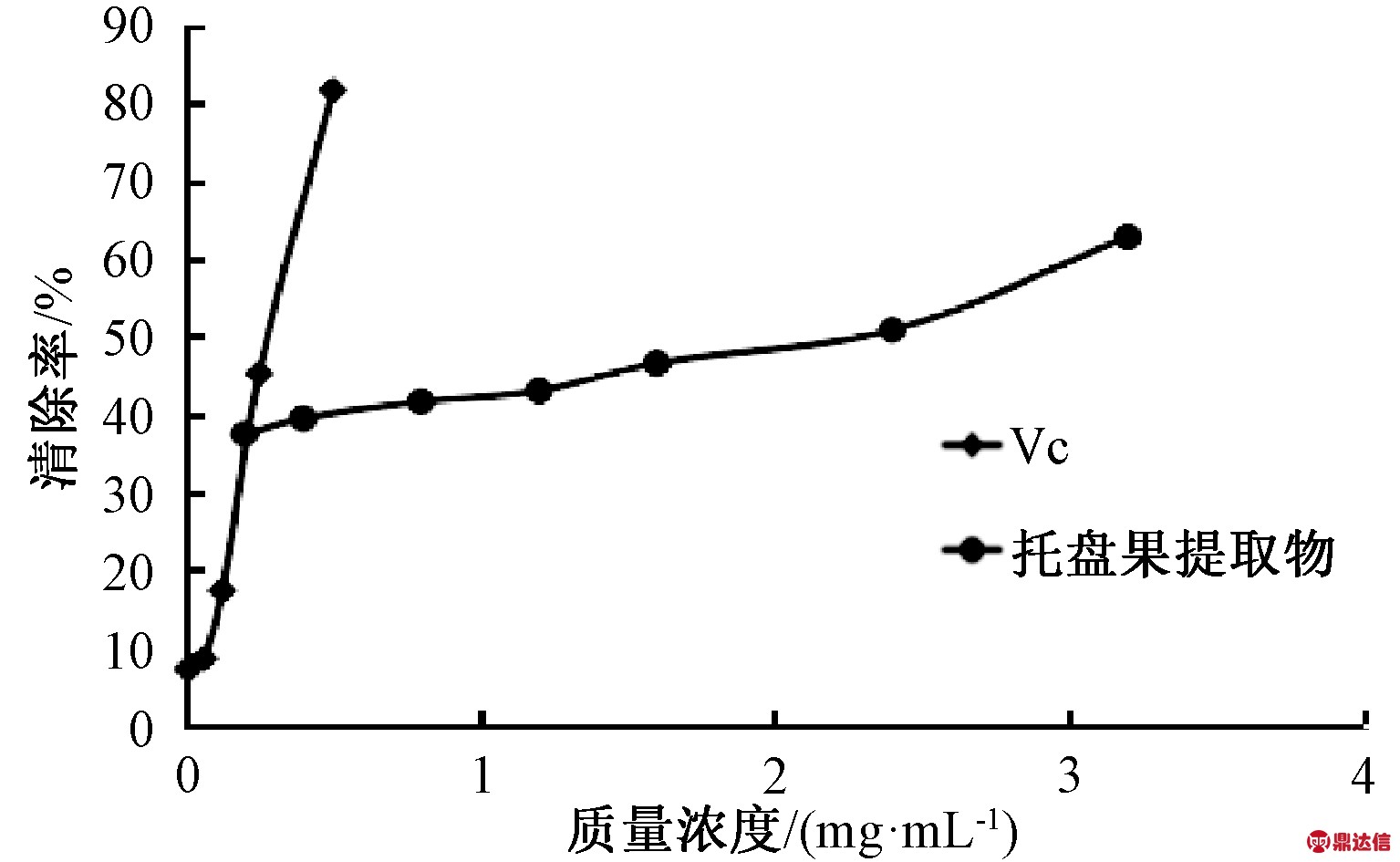
图3 超氧阴离子自由基的清除能力
Fig.3 The scavenging ability of superoxide anion radical
2.5 羟基自由基清除能力
由图4可知,托盘果醇提取物的羟基自由基清除率在质量浓度范围0.2~3.2 mg/mL内具有明显的浓度依赖关系。托盘醇果提取物清除羟基自由基的IC50值为2.120 mg/mL,VC的IC50值为0.545 mg/mL,说明托盘醇果提取物羟基自由基清除能力低于VC,试验结果说明,托盘果醇提取物能较多地清除羟基自由基,具有一定的抗氧化能力。
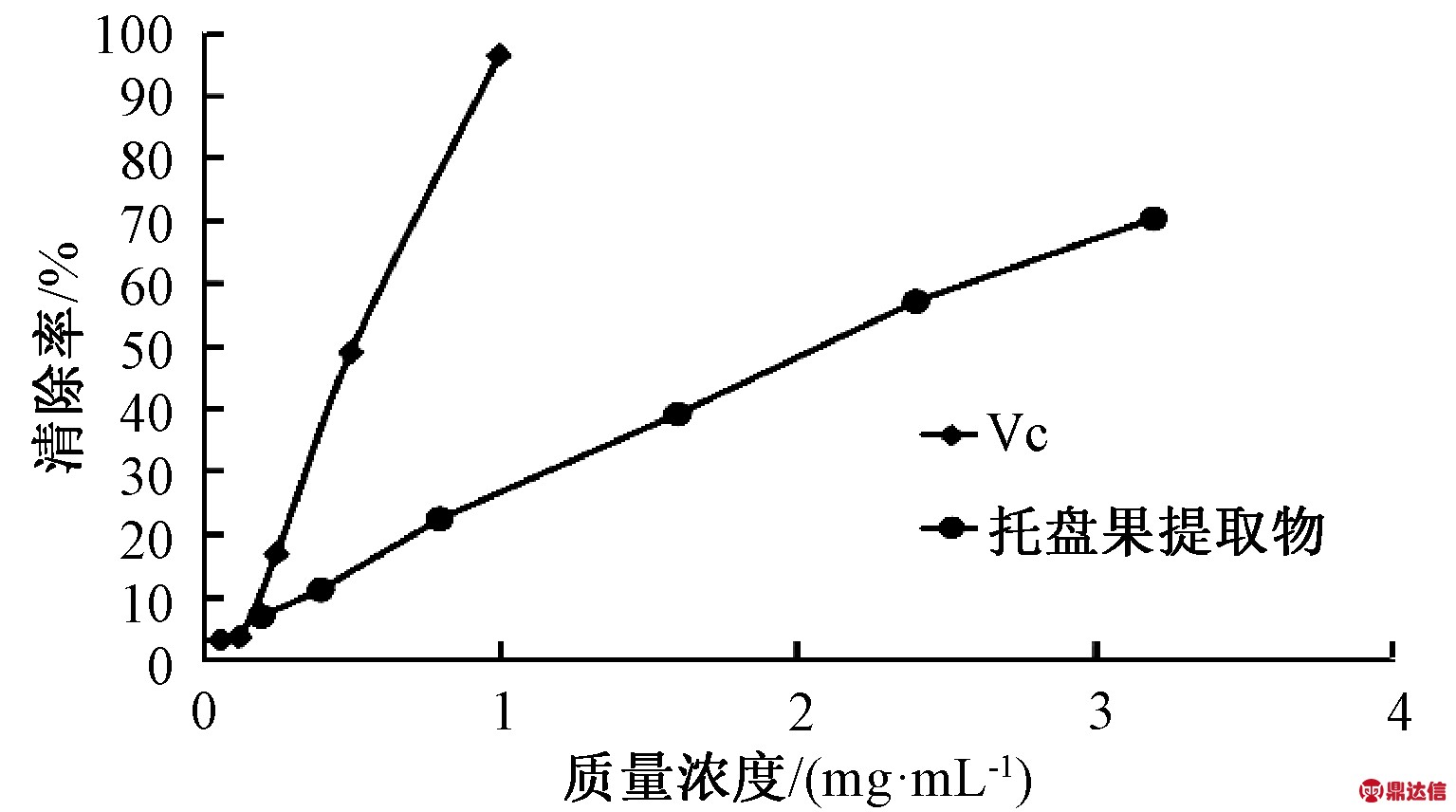
图4 羟基自由基的清除能力
Fig.4 Hydroxyl radical scavenging ability
3 结论
本试验采用醇提法提取托盘果总黄酮、总酚酸、总氨基酸,用水提醇沉法提取总多糖,用溶剂萃取法提取总皂苷,并对以上功能性成分进行了测定。试验结果为:托盘果中总黄酮含量1.31%,总酚酸含量0.44%,总皂苷含量0.96%,总氨基酸含量1.39%,总多糖含量0.55%。
探讨了托盘果醇提取物的抗氧化能力,结果表明,托盘果醇提取物对DPPH自由基清除率,ABTS自由基清除率都较高,其清除率较VC低。对超氧阴离子自由基和羟基自由基清除能力稍弱,且质量浓度对清除率影响不显著。说明托盘果醇提取物具有较强的体外抗氧化活性,本研究为托盘果的进一步开发和利用提供了理论依据。



