摘要:以5-氨基异酞酸为初始原料,通过酯化、肼解和席夫碱等反应合成了双三齿配体LD,并通过与锌离子(Zn2+)自组装构筑了金属(锌)-有机大环化合物LD-Zn,利用紫外-可见光谱、核磁、电喷雾质谱等表征手段研究了LD-Zn对氨基葡萄糖的识别作用。核磁光谱和电喷雾质谱测试表明,氨基葡萄糖分子能够进入到大环LD-Zn内部,并且LD-Zn以1∶1的比例包合了氨基葡萄糖分子。紫外-可见光谱表明,当向LD-Zn中加入氨基葡萄糖后,373 nm处的吸收峰强度增加,269 nm和303 nm处的吸收峰强度降低,平衡常数K达到4.19×103 L/mol,最低检测限为5.0×10-6mol/L。通过对比测试发现,LD-Zn只对氨基葡萄糖有紫外光谱响应,而对葡萄糖和三乙胺无任何响应,说明氨基葡萄糖的结构与大环化合物LD-Zn的空腔更匹配,LD-Zn对氨基葡萄糖的识别不是单纯羟基(氢键)或者氨基(碱性)引起的,而是由LD-Zn限域的空腔效应和氨基的氢键协同作用实现了对氨基葡萄糖的识别。
关 键 词:氨基葡萄糖;大环化合物;光谱分析;检测
1 引 言
氨基葡萄糖(Glu)又叫葡萄糖胺,是葡萄糖的羟基被氨基取代的产物,却与葡萄糖有着不同的生理活性。氨基葡萄糖是脂类糖基化反应和蛋白质的前体、关节软骨的营养素,能够帮助维护和修复软骨,促进软骨蛋白聚糖的合成和软骨细胞的生长,对骨关节炎具有特殊的治疗作用。而且,它具有抗衰老、抑菌、促进减肥、吸收体内的自由基、调节内分泌等多种功能,在医药、保健品、化妆品和食品等领域有着重要的应用[1-5]。因此,开发能够高灵敏度、快速检测氨基葡萄糖的技术,将对靶向性药物开发、新型食品和化妆品等产品添加剂的合成具有重要的意义。
然而,由于糖类化合物体积大,而且每种糖类结构间差别细微,仅通过羟基(—OH)或氨基(—NH2)活性基团来识别和区分不同糖类化合物具有很大的难度[6-7]。大环(或笼状)化合物具有花样繁多的空间结构和稳定、丰富的光(电)信号,它特定几何形状的空腔及大量的分支和桥联基团为目标分子提供了弱作用环境,在分子、离子识别和催化方面具有绝对的优势,是模拟酶催化和生物分子识别过程的重要模型[8-9]。国内外科学家利用大环(或笼状)化合物的特点,在生物分子检测识别方面做出了诸多有价值的工作[10-12]。Davis等[13]利用富含芳环和酰胺的笼状立体结构和氢键的协同作用,实现了对二糖和单糖光谱识别。Fujita等[14]利用球形笼状立体结构研究了对糖类分子的识别;大连理工大学的段春迎课题组[15]将喹啉基团与酰胺基团引入到八面体笼状化合物结构中,实现了对氨基葡萄糖的识别与传感,这些工作充分显现了大环和笼状化合物的魅力所在。
由于酰胺基团中的羰基和氨基能够分别与富含氢键位点的客体形成不同类型的氢键,而且在氢键形成过程中会引起主体分子骨架的电子再分配,进而产生特征的识别信号,有助于对生物分子的识别研究。因此,本文首先在有机配体中引入酰胺基团,以5-氨基异酞酸为初始原料,通过酯化、肼解和席夫碱等反应合成含有酰胺基团的双三齿配体LD,再通过两侧的三齿(酰胺基团的O、席夫碱的N和吡啶N)配位点与Zn2+(六配位)自组装构筑金属(锌)-有机三元大环化合物LD-Zn,通过大环的限域作用及主客体间的氢键作用,并利用紫外光谱法、核磁、电喷雾质谱等手段研究LD-Zn对氨基葡萄糖的识别作用。
2 实 验
2.1 仪器与试剂
仪器:熔点用X-6显微熔点测定仪测定(美国SRS公司);电喷雾质谱使用HPLC-Q-Tof MS型质谱仪测定,流动相为甲醇(美国 Agilent公司);C、H、N元素分析使用Vario ELⅢ元素分析仪测定(德国Elementar公司);1H NMR使用Varian INOVA 400核磁共振谱仪测定(TMS为内标,美国Varian公司);红外光谱使用Nicolet NEXUS 670 FT-IR光谱仪测定(美国Nicolet公司);紫外-可见光谱使用HP8453紫外-可见光谱仪测定(美国Agilent公司)。
试剂:5-氨基异酞酸、亚硫酰氯、苄基溴、80%的水合肼、2-吡啶甲醛、氨基葡萄糖、葡萄糖、碳酸钾、冰醋酸、乙腈、甲醇、二氯甲烷、无水硫酸镁。上述试剂均为分析纯。
2.2 实验过程
2.2.1 配体LD的合成
配体LD的合成过程见图1,具体实验步骤如下。
化合物L-1的合成:向250 mL三颈烧瓶中加入5-氨基异酞酸(44.2 mmol,8 g)和 160 mL 甲醇,并用恒压漏斗滴加过量的亚硫酰氯(SOCl2),室温反应20 h,得到目标产物L-1(白色固体)。
化合物L-2的合成:在乙腈溶液中,化合物L-1(9.6 mmol,2 g)与苄基溴(24.1 mmol,4.1 g)在K2CO3(19.6 mmol,2.7 g)催化下反应 6 h(反应温度为80℃),冷却后将乙腈除去后,用 H2O/CH2Cl2萃取,有机相用无水MgSO4干燥24 h,过滤、旋干,得到化合物L-2(白色固体)。
化合物 L-3的合成:称取化合物 L-2(5.1 mmol,2 g)放入烧瓶中,分别加入120 mL甲醇及过量的水合肼(80%)回流反应24 h,得到目标产物L-3(白色固体)。
配体 LD的合成:称取 2-吡啶甲醛(11.9 mmol,1.27 g)、化合物 L-3(5.1 mmol,2 g)放入烧瓶中,向其中加入甲醇溶剂,再加入几滴冰醋酸回流反应24 h,得到产物LD(白色固体)。熔点:189.1~190.9 ℃;元素分析(LD(C34H29O2N7)+CH3OH)计算值:C,70.10%;N,16.35%;H,5.55%;实验值:C,69.34%;N,16.48%;H,5.35%。电喷雾质谱:m/z calcd 590.3归属于物种[LD+Na+],m/z calcd 568.2归属于物种[LD+H+]。1H NMR(d6-DMSO):4.84(4H,s),7.28(7H,m),7.35(4H,d,J=7.2 Hz),7.43(3H,t,J=15.6 Hz),7.68(1H,s),7.90(2H,t),7.97(2H,d,J=7.6 Hz),8.47(2H,s),8.62(2H,d,J=8.4 Hz),12.03(2H,s,HCONH)。IR(KBr 压片):695(w),742(w),1 157(w),1 246(w),1 346(w),1 494(m),1 579(s),1 468(m),1 661(s),1692(m),2 833(w),2 923(s),3 434(m)cm-1。
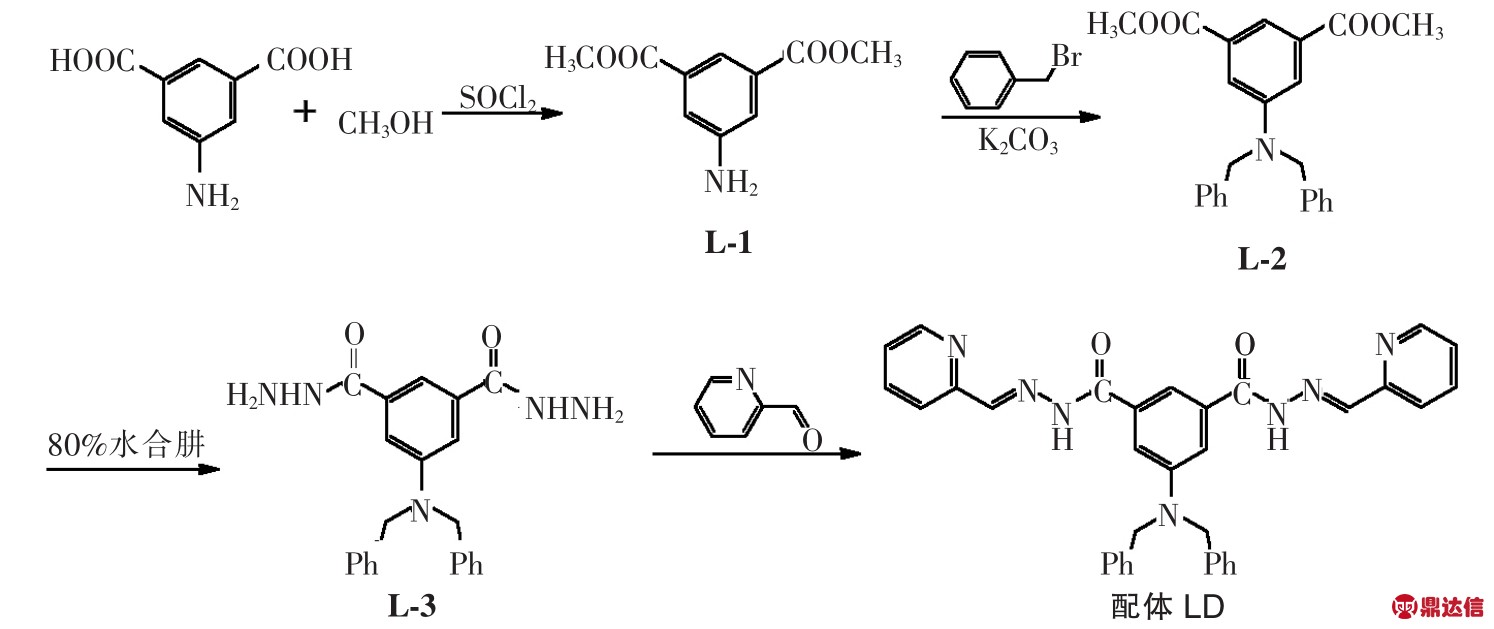
图1 配体LD的合成示意图
Fig.1 Synthetic route of ligand LD
2.2.2 金属(锌)-有机大环化合物LD-Zn的合成
将配体 LD(0.30 mmol,170 mg) 溶解在10 mL乙腈/甲醇(2∶10,体积比)溶液中,再将Zn(NO3)2獉6H2O(0.30 mmol,89.2 mg) 溶解在2 mL甲醇中,二者混合后在室温下搅拌30 min,再向其中加入六氟磷酸铵,得到淡黄色沉淀(LD-Zn)。元素分析(C102H87N21O6Zn3(PF6)4·3H2O·3CH3CN)计算值:C 48.84,H 3.87,N 12.66;实验值:C 48.51,H 3.68,N 12.62。IR(KBr 压片):558(s),845(s),1 085(w),1 156(m),1 257(m),1 294(m),1 358(s),1 384(s),1 475(m),1 535(m),1 595(s),1 631(m),3 030(w),3 434(m)cm-1。
2.3 LD-Zn对氨基葡萄糖的识别
2.3.1 配制溶液
将化合物LD-Zn配制成1.0×10-3mol/L的DMF(N,N-二甲基甲酰胺)溶液,氨基葡萄糖和葡萄糖分别配制成1.0×10-2mol/L的水溶液,测试时用CH3CN/H2O(9∶1,体积比)的溶液稀释到所需要的浓度。
2.3.2 紫外-可见光谱测试
向比色皿中加入2 mL化合物LD-Zn溶液(1.0×10-5mol/L),然后分别向其中加入客体分子(氨基葡萄糖或葡萄糖),由低倍数到高倍数,直至平衡,测定LD-Zn对不同客体分子在260~600 nm之间的紫外-可见吸收光谱。
3 结果与讨论
3.1 电喷雾质谱测试
图2是LD-Zn的电喷雾质谱测试结果。从图中可以观察到6个峰,m/z calcd 632.350 1归属于物种[(LD-H+)3Zn3]3+,m/z calcd 680.691 1归属于物种[(LD-H+)3Zn3+PF6]3+,m/z calcd 947.534 1 归属于物种[(LD-2H+)3Zn3]2+,m/z calcd 978.526 1 归属于物种[(LD-2H+)3Zn3+NO3]2+,m/z calcd 1 021.027 2 归属于物种[(LDH+)3Zn3+PF6]2+,m/z calcd 1 093.033 9 归属于物种[(LD)3Zn3-5H++(PF6)2]2+,这些数据表明配体LD通过O、N、N双三齿配位点与Zn2+(六配位)形成三元大环结构,如图3所示,该结构在溶液中能够稳定存在。
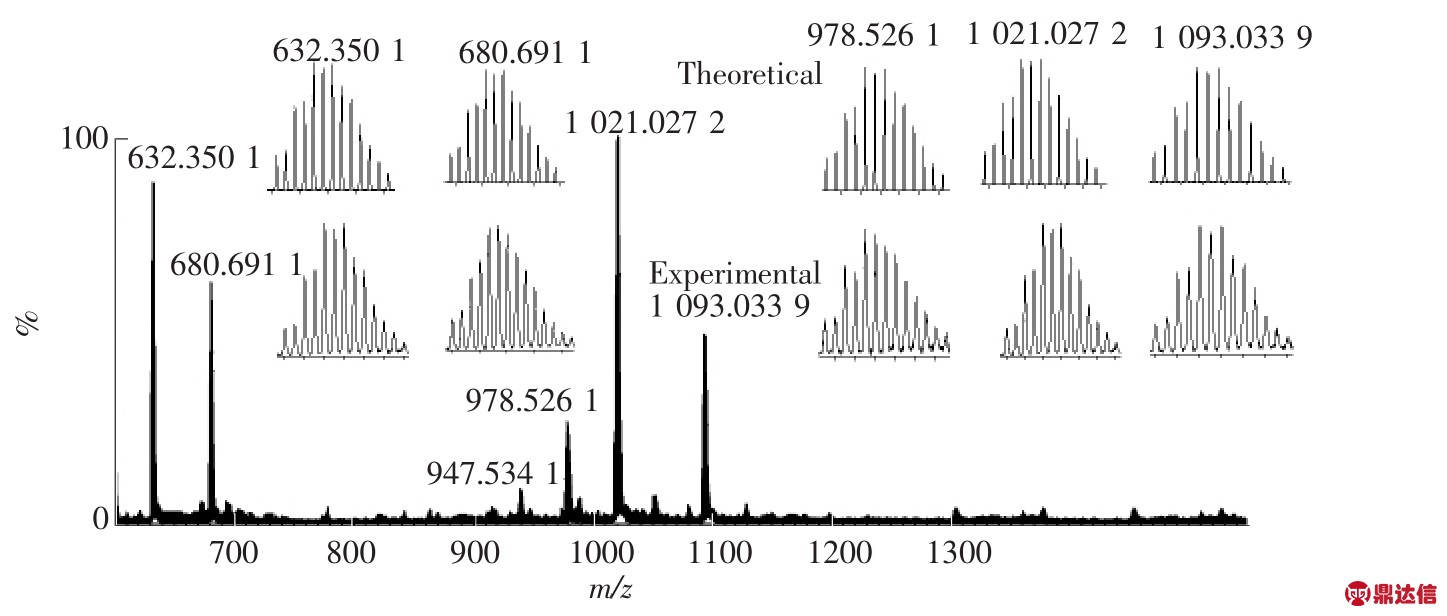
图2 金属(锌)-有机大环化合物LD-Zn的ESI-MS谱图
Fig.2 ESI-MS of zinc-based macrocyclic compound LD-Zn
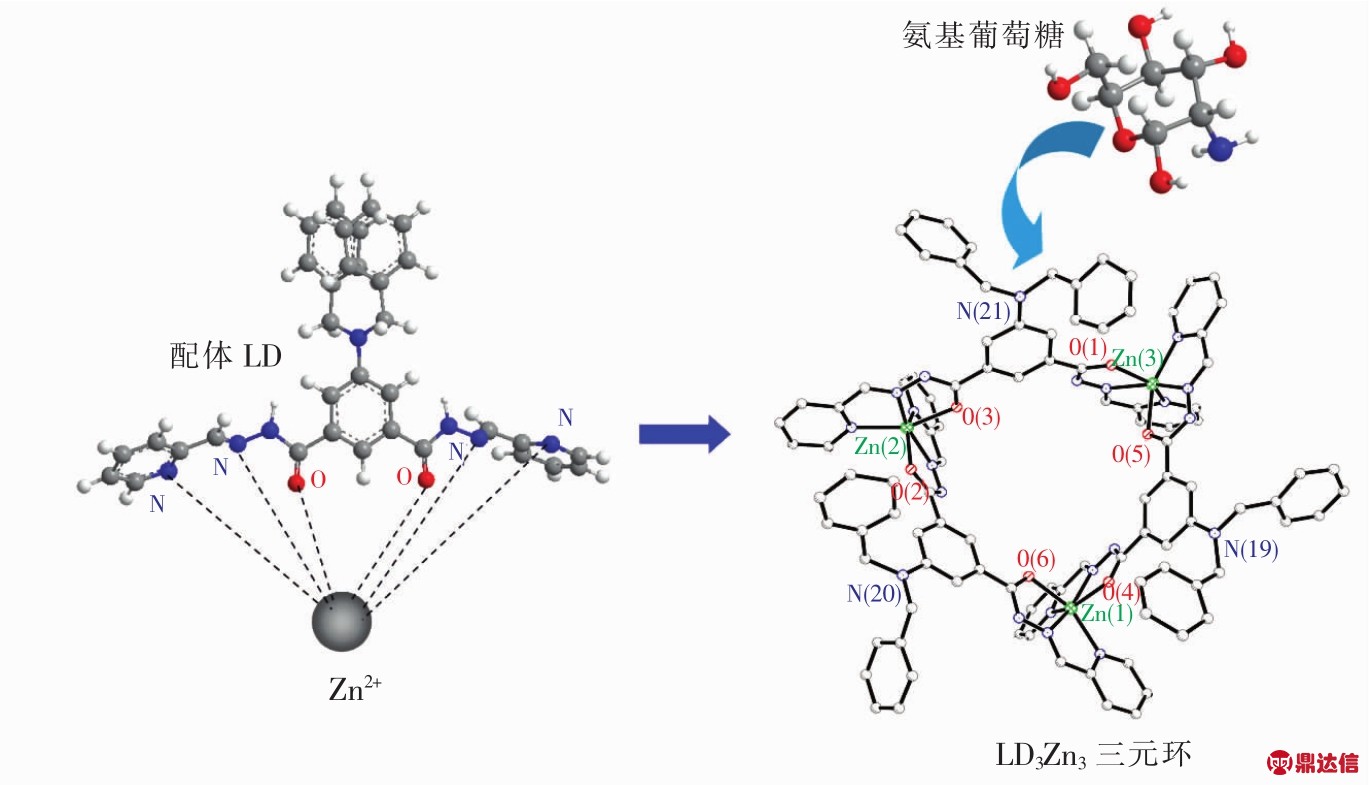
图3 配体LD与Zn2+自组装构筑金属(锌)-有机大环化合物LD-Zn(LD3Zn3)及包合氨基葡萄糖示意图
Fig.3 Formation schematic diagram of zinc-based macrocyclic compound LD-Zn for detection of glucosamine
向大环化合物LD-Zn中加入氨基葡萄糖后,其电喷雾质谱测试谱图如图4所示。图中显示了4 个正电荷峰,其中 m/z 632.350 1,947.534 1,1 021.027 2为大环化合物LD-Zn的谱峰(见图2),m/z calcd 1 199.767 5二价正电荷峰归属为物种[(LD)3Zn3+PF6+Glu(氨基葡萄糖)+CH3OH+3CH3CN+H2O]2+,说明大环化合物 LD-Zn以1∶1的比例包合了氨基葡萄糖分子。
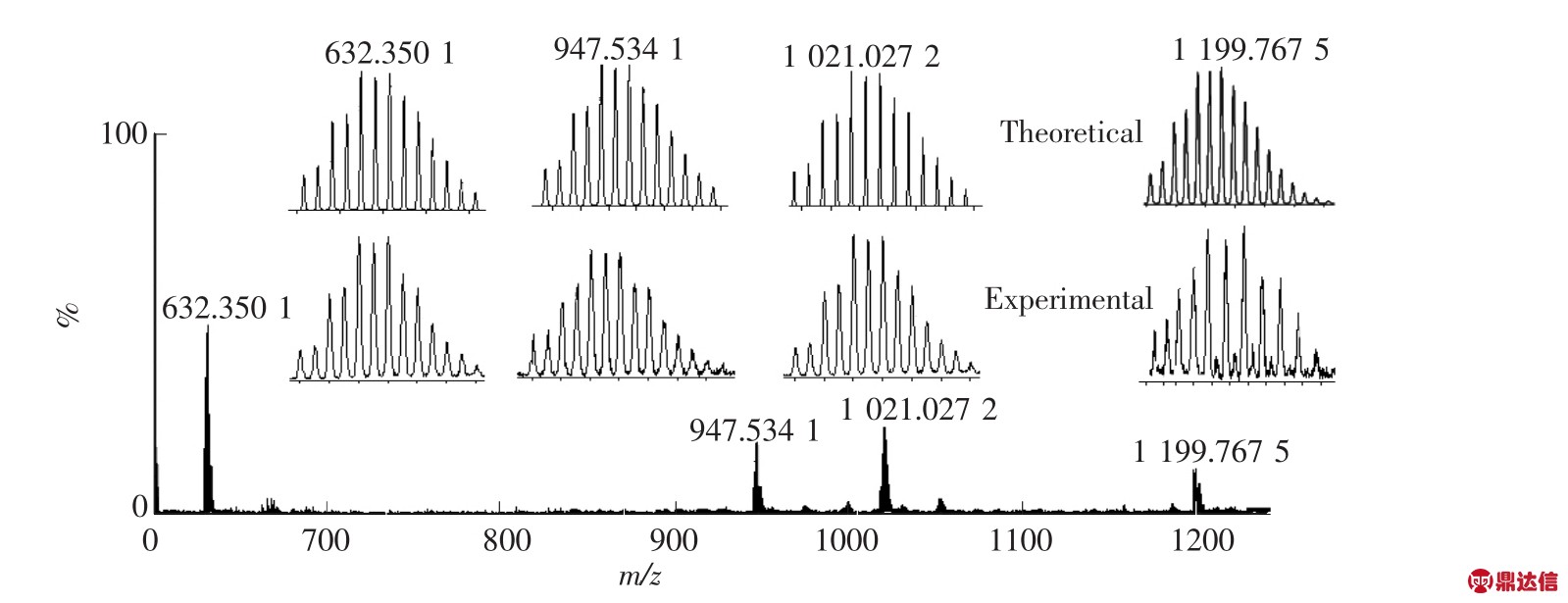
图4 向LD-Zn中加入氨基葡萄糖的ESI-MS谱图
Fig.4 ESI-MS spectra of LD-Zn in the presence of glucosamine
3.2 核磁光谱测试
大环化合物LD-Zn对氨基葡萄糖识别的核磁光谱测试如图5所示,其中(a)为大环LD-Zn的1H NMR核磁光谱,(b)为向大环LD-Zn中加入等摩尔氨基葡萄糖的1H NMR核磁光谱,(c)为氨基葡萄糖的1H NMR核磁光谱,从图中可以看出氨基葡萄糖上的HC—H(—O—CH—OH)明显向低场移动,说明氨基葡萄糖已经进入大环内部[14]。
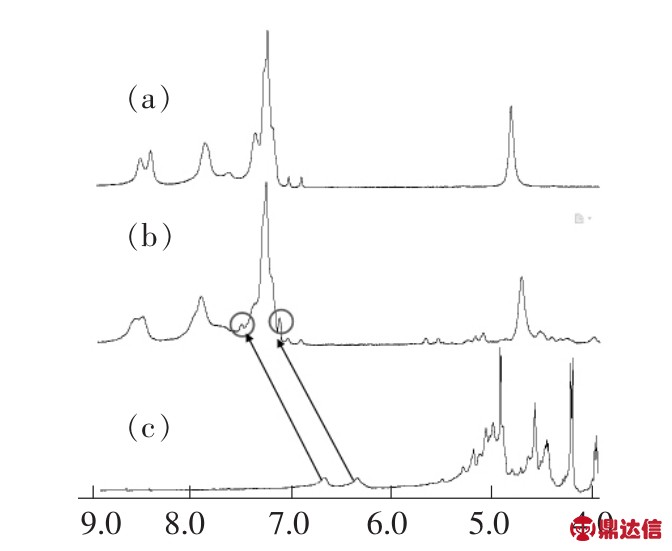
图5 (a)LD-Zn的1H NMR谱;(b)向LD-Zn加入氨基葡萄糖后的1H NMR谱;(c)氨基葡萄糖的1H NMR谱,溶剂(d6-DMSO)。
Fig.5 (a)1H NMR spectra of LD-Zn.(b)LD-Zn upon addition of glucosamine in a solution of d6-DMSO.(c)LD-Zn upon addition of glucosamine in a solution of d6-DMSO.
3.3 紫外光谱测试
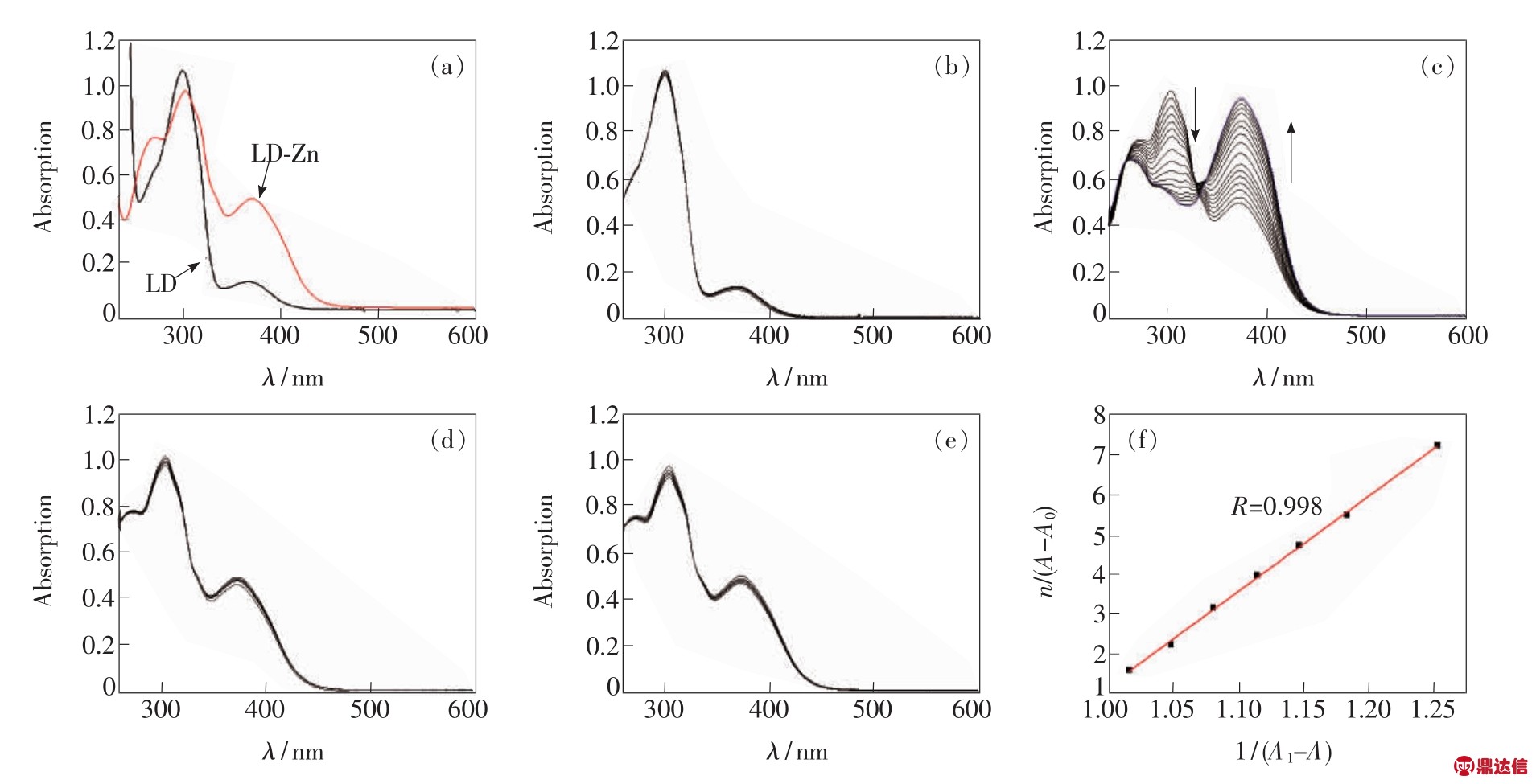
图6 (a)单纯配体LD和金属(锌)-有机大环化合物LD-Zn的紫外-可见吸收光谱图;(b)在配体LD中加入氨基葡萄糖的紫外滴定光谱;(c)在LD-Zn(10#mol/L)中加入氨基葡萄糖的紫外滴定光谱;(d)在大环LD-Zn中加入葡萄糖的紫外滴定光谱;(e)在LD-Zn中加入三乙胺的紫外滴定光谱;(f)LD-Zn包合氨基葡萄糖的Benesi-Hildebrand拟合图。
Fig.6 (a)UV-Vis spectra of ligand LD and LD-Zn.(b)UV-Vis titration spectra of LD.(c)UV-Vis titration spectra of LD-Zn upon addition of glucosamine.(d)UV-Vis titration spectra of LD-Zn by adding glucose.(e)UV-Vis titration spectra of LD-Zn by adding triethylamine.(f)Benesi-Hildebrand fitting of UV-Vis titration upon addition of glucosamine into LD-Zn.
在 CH3CN/H2O(9∶1,体积比)溶液中,单纯配体LD在303 nm处出现较强吸收峰,在373 nm处出现较弱吸收峰,当与锌离子配位后在269 nm处出现新的吸收峰,同时保留了303 nm和373 nm处的吸收峰,并且373 nm处吸收峰强度增强,如图6(a)所示。图6(b)是向配体LD中加入氨基葡萄糖的紫外-可见吸收光谱图,从图中可以看出LD对氨基葡萄糖没有任何响应。当向大环化合物LD-Zn中加入氨基葡萄后,373 nm处的吸收峰强度逐渐增加,269 nm和303 nm处的吸收峰强度逐渐降低,直至平衡,如图6(c)所示,表明客体氨基葡萄糖进入到大环LD-Zn内部。在此基础上,为了进一步研究LD-Zn对氨基葡萄糖的响应是否来源于糖环结构或者氨基的碱性,分别对葡萄糖和三乙胺进行了测试。图6(d)和图6(e)为分别向LD-Zn中加入葡萄糖和三乙胺后的紫外-可见光谱测试结果。从图中可以看出LD-Zn对葡萄糖和三乙胺均没有任何响应,说明相对葡萄糖而言,氨基葡萄糖的结构与大环LD-Zn的空腔更匹配。这主要是由于LD-Zn对氨基葡萄糖的识别不是单纯羟基(氢键)或者氨基(碱性)引起的,而是LD-Zn限域的空腔和与氨基的氢键等协同作用实现了对氨基葡萄糖的识别。这与He等[5]用富含酰胺氢键的八面体笼状化合物识别氨基葡萄糖的机理相似,由于酰胺基团与氨基葡萄糖之间形成氢键,导致大环LD-Zn骨架的电子变化,进而紫外光谱有可视化的识别信号输出。而且该研究利用更为简单的大环结构实现了对氨基葡萄糖的识别,最低检测限可达到5.0×10-6mol/L。以氨基葡萄糖加入量与373 nm处吸收峰强度的对应关系,利用1∶1包合公式(1)进行Benesi-Hildebrand拟合,如图6(f)所示,得到LD-Zn包合氨基葡萄糖的平衡常数 K=4.19 ×103mol-1·L。
其中,n为加入氨基葡萄糖的倍数,K为平衡常数,C0为LD-Zn的浓度,A0为大环化合物LD-Zn(浓度为C0)的吸光度值,A为在大环LD-Zn中加入一定量氨基葡萄糖后的吸光度值,Al为在大环LD-Zn中加入过量氨基葡萄糖的最大吸光度值。
4 结 论
通过双三齿配体LD与锌离子(Zn2+)自组装构筑了金属(锌)-有机大环化合物LD-Zn,并研究其对氨基葡萄糖的识别作用。结果表明,大环LD-Zn能够1∶1包合氨基葡萄糖分子,引起373 nm处的吸光度逐渐增强,269 nm和303 nm处的吸光度逐渐减弱,平衡常数 K达到4.19×103 mol-1·L,最低检测限为 5.0 × 10-6mol/L,大环化合物LD-Zn通过特定几何性质和尺寸的空腔和氢键的协同作用实现了对氨基葡萄糖的高灵敏度检测。



