摘要:利用贵金属纳米颗粒独特的物理特性,设计具有信号放大功能的荧光适体传感器用于多巴胺的浓度检测。基于金属荧光增强效应通过在金纳米颗粒与荧光基团之间添加隔离层的手段实现荧光信号放大。将化学修饰了SH键的核酸适体与金纳米颗粒溶液混合,形成稳定的Au-S键结构并与标记荧光基团的DNA互补链利用碱基互补配对原则结合。然后,通过调节所设计的核酸适体5′所添加的碱基A的数量,从而调节荧光基团与金纳米颗粒表面的距离。同时,优化核酸适体与金纳米颗粒之间的浓度比以及所处的反应环境的pH值,获得最佳的放大效率。最后对不同浓度的多巴胺进行测试。实验结果表明:金纳米颗粒溶液与核酸适体在一定的浓度比之下,在隔离层厚度为27个碱基A时,最大的荧光增强倍数为2.35。多巴胺浓度检测的线性范围为20~100 nmol/L, 最低检测限为20 nmol/L。该传感器可以在纳米级有效调控隔离层厚度,提供了一种稳定的信号放大策略。
关 键 词:生物传感器;金纳米颗粒;金属增强荧光效应;核酸适体
1 引 言
荧光适体传感器因具有高灵敏度,简单性和高检测效率已被广泛用于环境传感[1],食品安全[2]和临床分析[3-4]。该传感器主要利用核酸适体与靶目标特异性结合前后所产生的荧光信号的变化来反应被测物的浓度。虽然荧光适体传感器在生物医学领域已经有着突出的贡献,但是由于被测物所处的环境复杂,且背景噪声较大,一些痕量生物分子所引起的信号变化微弱,难以监测。比如在血液中胰岛素、多巴胺、三磷酸腺苷(ATP)等的浓度均为ng/mL[6-8]。此外,人们已经普遍认识到,在疾病的早期阶段,相关的生物标志物的浓度通常在一个较低的水平。因此,提高传感器的灵敏度对临床疾病诊断和治疗有重要意义[9]。
近年来,由于贵金属纳米粒子具有独特的物理化学特性以及良好的光学特性,被广泛地应用于生物传感器中[10-12]。Wang等开发了一种基于适体纳米银荧光增强的夹心法测定多重组分的荧光传感器,实现多重分析,而且检测的灵敏度较高,也有很好的选择性[13]。Li[14]等开发了一种基于银纳米粒子杂交聚合探针检测免疫球蛋白的方法,免疫球蛋白的检测限能达到211 fmol/L,实现了对免疫球蛋白的高灵敏度检测。Ye[15]等开发了一种基于金纳米粒子的新型表面增强拉曼传感器,实现对不同水平的ATP 的放大检测。
近年来,人们主要通过在金属纳米颗粒与荧光基团之间添加隔离层方式,获得最佳的隔离层厚度,得到一种具有信号放大效应的核壳结构的荧光适体传感器。从已有理论和实验研究可知,荧光分子与金属表面之间的间距在增强效应中具有重要的作用[16]。现有的主要的无机隔离层材料为SiO2[17-18],纳米多孔二氧化硅[19],聚合物[20]等。然而,这些材料本身不具备选择性,且制备过程繁琐。本文主要采用具有特意性选择的核酸适体作为识别元件,通过基因编程在核酸适体5′修饰碱基A序列段,同时化学修饰硫氢键(SH),通过调控碱基A的数量,实现在纳米级调控隔离层厚度以及最大荧光增强,从而提高荧光传感器的选择性与灵敏度。
2 实 验
2.1 传感器原理
图1为多巴胺荧光增强型适体传感器的检测原理图。经过化学修饰的核酸适体与金纳米颗粒通过Au-S键结合,形成了AuNPs/Aptamer 的缀合物。然后,标记了荧光基团Cy3 的核酸适体互补链与核酸适体遵循碱基互补配对的原理结合,形成的纳米结构AuNPs/Aptamer/Cy3-DNA 即为具有荧光信号放大功能的传感器。随着被测物的加入,被测物与核酸适体的特异性结合,使得Cy3-DNA解离,然后经过离心去除被解离的Cy3-DNA,对底物进行荧光检测。
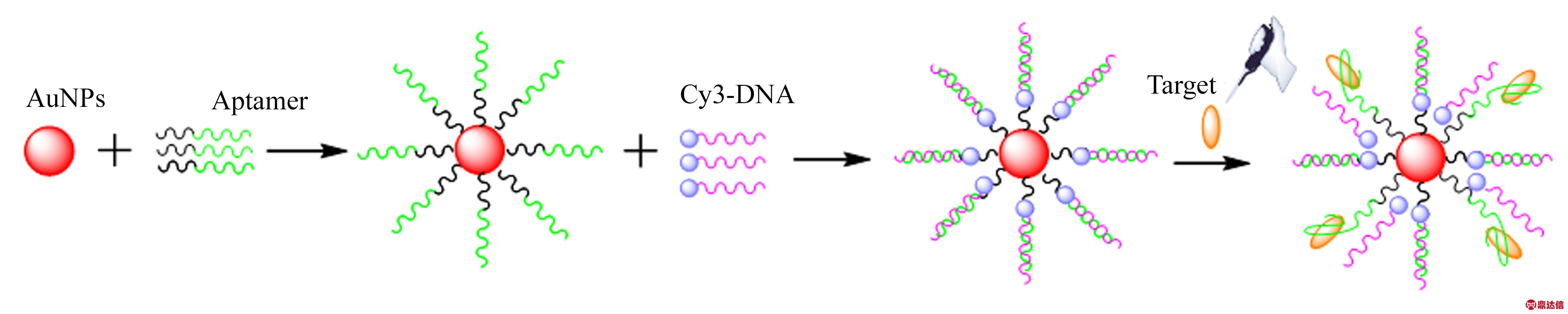
图1 多巴胺荧光增强型适体传感器检测原理
Fig.1 Schematic diagram of dopamine detection by flurescence-enhanced aptamer sensor
2.2 仪器与试剂
实验仪器有:F-7000型荧光光谱仪(日本HITACHI公司);SYU-22-500DTD型超声波清洗器(郑州生元仪器有限公司);GL-16Ⅱ型离心机(上海安亭科学仪器厂);HZQ-F200振荡培养箱(北京东联哈尔仪器制造有限公司);07HWS-2数显恒温磁力搅拌器(杭州仪表电机有限公司);电子天平(梅特勒-托利多仪器(上海)有限公司);FE20K酸度计(梅特勒-托利多仪器(上海)有限公司)。实验试剂有:PBS缓冲液,10 mmol/L,pH7.4;Tris-HCl,10 mmol/L,pH5.2;所有化学试剂均为分析级实验用水,是电阻为18.2 MΩ的超纯水(PURELAB Option-R系列纯水机制备)。所用的TCEP、和DNA序列购自上海生工生物技术有限公司(中国)。
2.3 纳米金-核酸适体耦合物的制备
核酸适体(S0-S6)通过Au-S相互作用与AuNPs结合。首先,将5 μmol/L的核酸适体(S0-S6)用10 mmol/L,pH=5.2,Tris-HCl在乙酸盐缓冲液中活化2 h。然后,将浓度均为为1 μmol/L的AuNPs和核酸适体混合并定容为250 μL,37 ℃孵育至少18 h。然后,加入28 μL的1×PBS以调节所得溶液的pH值和离子强度,温育6 h,并以3 h的间隔重复两次加入2 mol/L NaCl,使得总NaCl最终浓度可以逐渐增加至0.1 mol/L。温育48 h后,以14 000 rpm离心15 min,200 μL, 0.1 mol/L PBS洗涤混合物。最后,将沉淀物再分散于1 mL,0.1 mol/L的PBS中并加入500 μL,1 μmol/L的Cy3-DNA,并在37 ℃孵育2 h,4 ℃保存备用。
2.4 靶目标的检测
将上述制备好的400 μL纳米金-核酸适体耦合物加入100 μL不同浓度的靶目标室温下孵育1 h。然后,5 000 r/min离心10 min,去除上清液,对底物进行荧光检测。
3 结果与分析
3.1 可行性分析
金属增强荧光(metal-Enhanced Fluorescence,MEF)指当荧光物质置于金属表面或附近时,其荧光发射强度比自由态荧光发射强度大幅增加的现象[21]。当金属纳米粒子与荧光物质之间的距离太近时,荧光物质与金属纳米粒子之间发生非辐射衰减,荧光猝灭; 而当金属纳米粒子与荧光物质之间的距离太远时,对荧光物质的影响非常小,荧光较弱,因此,只有当荧光物质与金属纳米粒子之间的距离合适才能得到最大的金属增强荧光[22]。本实验主要使用尺寸为20 nm的金纳米颗粒球体,通过改变核酸适体5′修饰的碱基A的数量,进一步调节增强荧光效率。
图2所示为AuNPs,Cy3-DNA, AuNPs/S4/Cy3-DNA的荧光光谱。可以看到,当Cy3-DNA单独存在时,荧光强度相对较低,随着本身不具有荧光的AuNPs的引入,荧光信号被放大。这是由于当荧光基团位于金属纳米颗粒附近时,金属增强荧光效应可以有效地放大荧光信号。
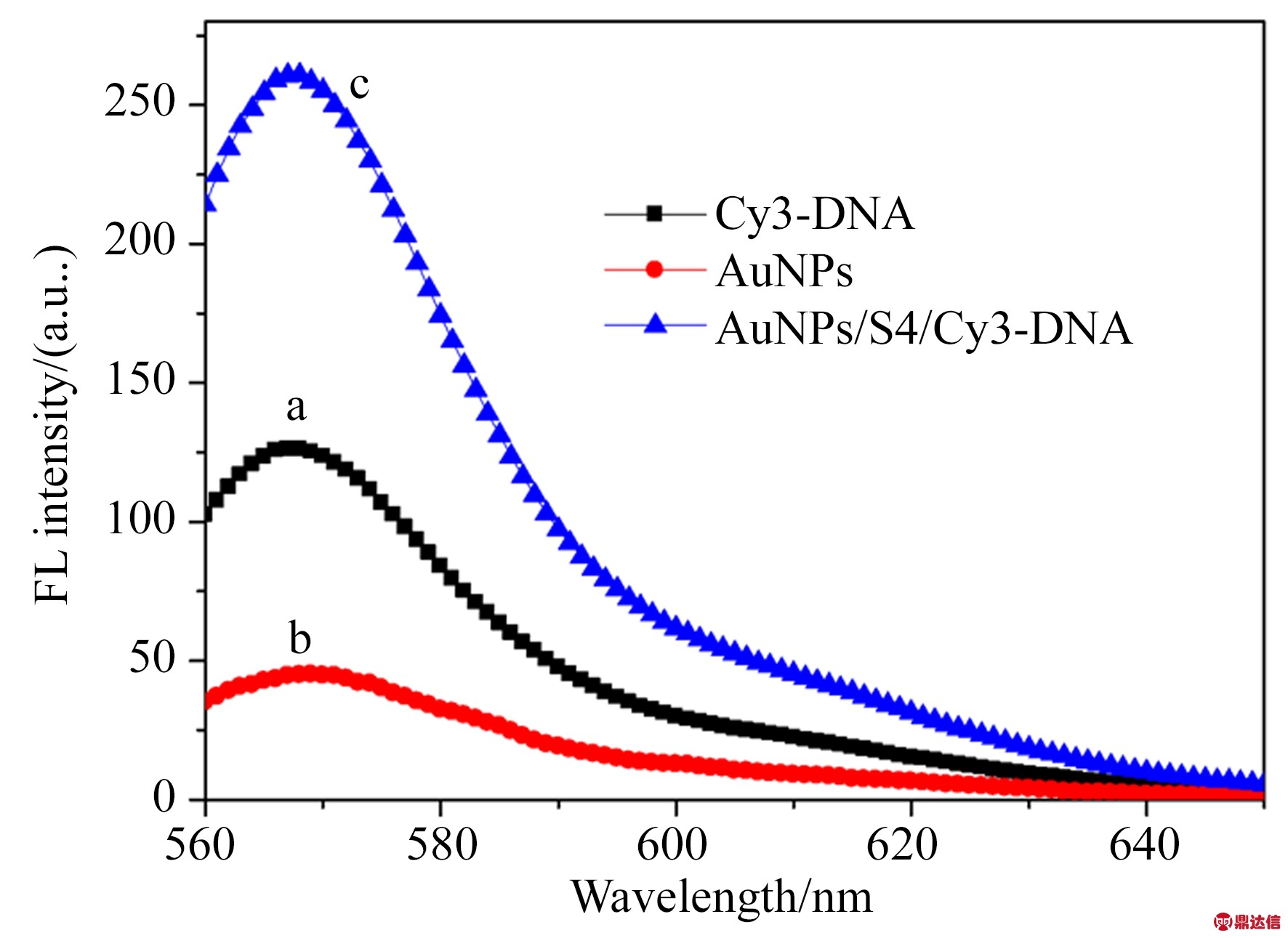
图2 Cy3-DNA、金纳米颗粒及核酸适体修饰的金纳米颗粒与互补链Cy3-DNA所制备的传感器的荧光光谱(AuNPs/S4/Cy3-DNA)
Fig.2 Fluorescence spectra of Cy3-DNA in blank control group, gold nanoparticles, sensor prepared by aptamer modified gold nanoparticles and hybridized with Cy3-DNA (AuNPs/S4/Cy3-DNA)
3.2 实验条件优化
金属纳米颗粒或金属膜可以增强或者猝灭荧光通常被用作猝灭剂。因此,AuNPs与荧光基团的浓度比十分重要。当AuNPs浓度过大时,过量的AuNPs会作为淬灭剂存在于溶液中,导致部分荧光发生猝灭,为了获得最大的荧光增强,在实验中所使用的AuNPs浓度为1 μmol/L,体积为20 μL,通过改变核酸适体在混合溶液中的浓度改变两者的浓度比,使得在混合溶液中核酸适体浓度为金纳米颗粒的1~10倍。图3(a)为制备的不同体积比的荧光光谱,图3(b)为(a)图中对应的567 nm处的最大荧光强度对应的折线图。由图3可知,AuNPs∶Aptamer=1∶5时,荧光信号放大达到最佳。此时,Cy3-DNA的荧光强度为118.4,放大后的荧光信号强度为279.3, F/F0=2.35。
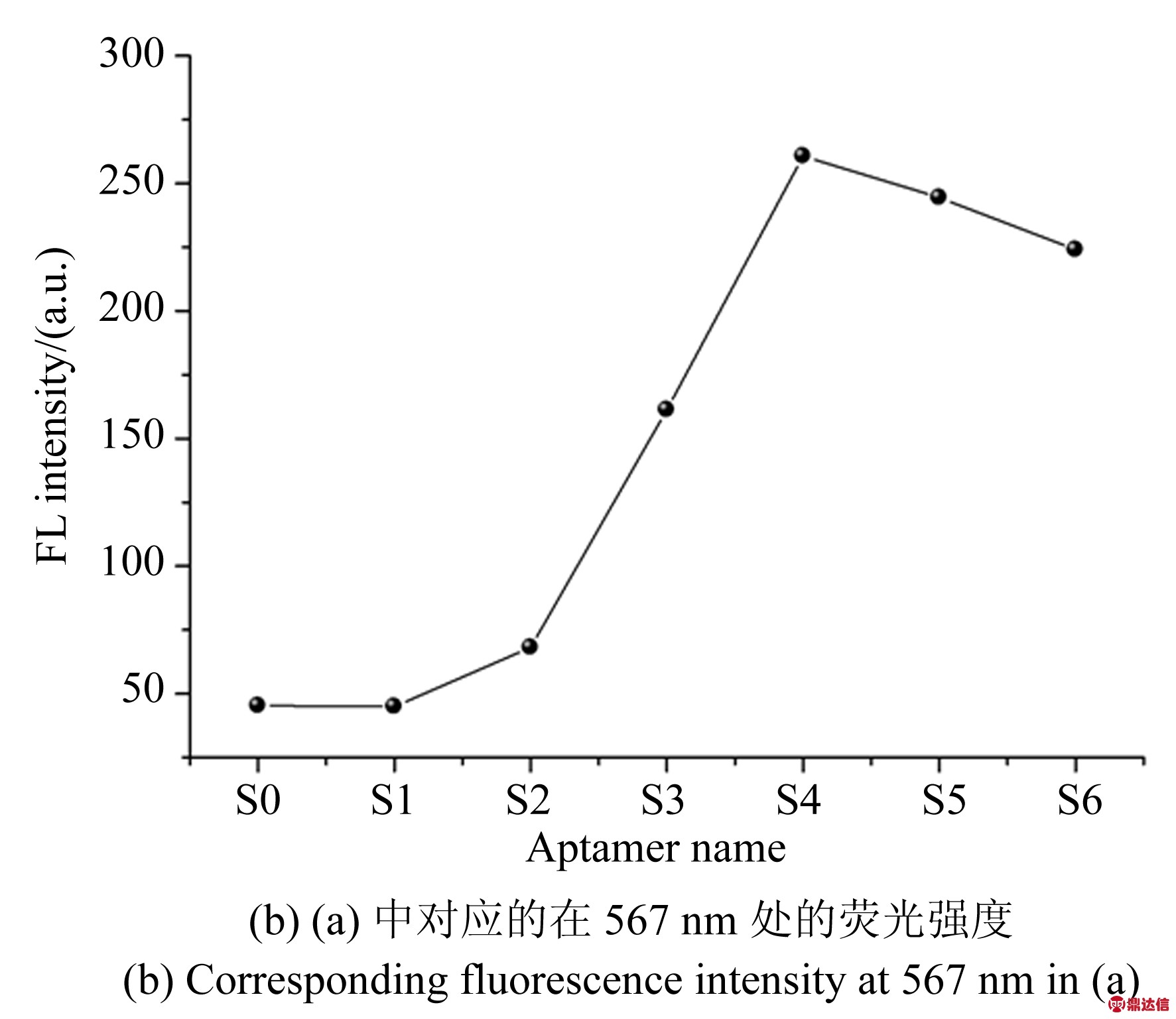

图3 AuNPs与核酸适体浓度比例优化
Fig.3 Optimization of AuNPs and aptamer concentration
除此之外,金属诱导荧光增强或者猝灭与金属纳米结构和荧光基团之间的距离密切相关。 当金属结构与荧光基团之间的距离在 5~100 nm时,金属表面等离子体共振使得荧光材料的本征辐射衰减率增加,荧光强度增强。当荧光基团和金属纳米粒子之间的距离小于5 nm时会导致荧光猝灭。因此,需要进一步优化隔离层的厚度。当碱基的数量分别为0,12,18,24,27,30和32时,构建了一系列探针,荧光光谱如图4(a)所示。当碱基A的数量为27时,信号放大效率最大。因此,为了获得高灵敏度传感器,将金纳米溶液与核酸适体的浓度设定为1∶5,并且将实验中核酸适体固定为S4 制备传感器并用于生物分子检测。
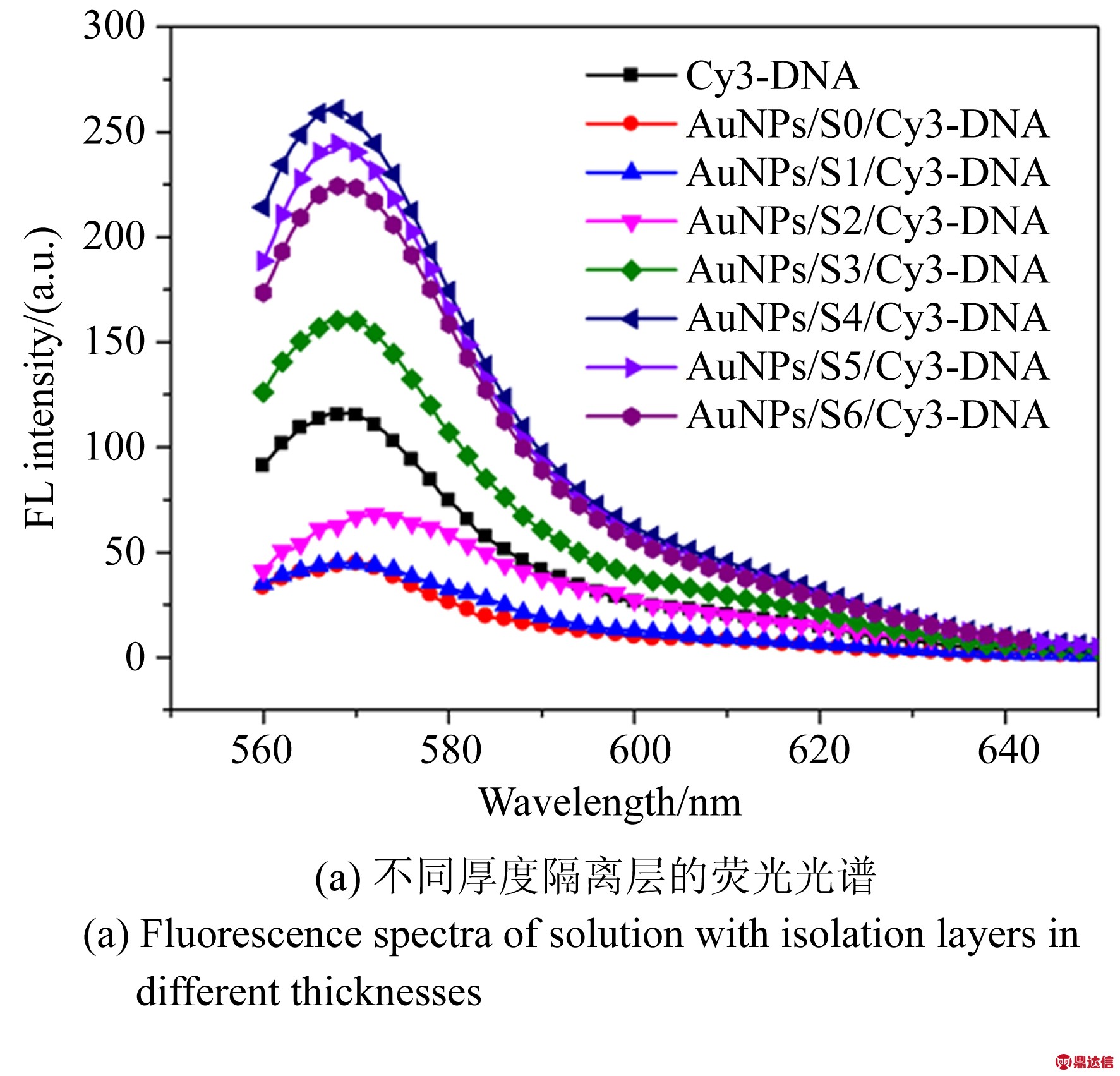

图4 隔离层厚度优化实验
Fig.4 Optimization of isolation layer thickness
3.3 多巴胺检测
在本实验中,将神经递质类物质多巴胺作为检测对象。在所制备好的每400 μL混合溶液中,分别加入浓度为20,40,50,100,200 nmol/L的多巴胺溶液。当加入多巴胺时,由于核酸适体与靶目标多巴胺的特异性结合,使得被标记荧光基团的互补链Cy3-DNA被解离出来,荧光强度有所降低。如图5所示,随着多巴胺浓度的增加,混合溶液的荧光强度逐渐降低。实验结果如图5(b)所示,在20~100 nmol/L的浓度内,荧光强度与靶目标的浓度为负相关,相关系数R2=0.98,线性回归方程为Y=167.29-0.57X(Y为荧光强度,X为多巴胺的浓度)。
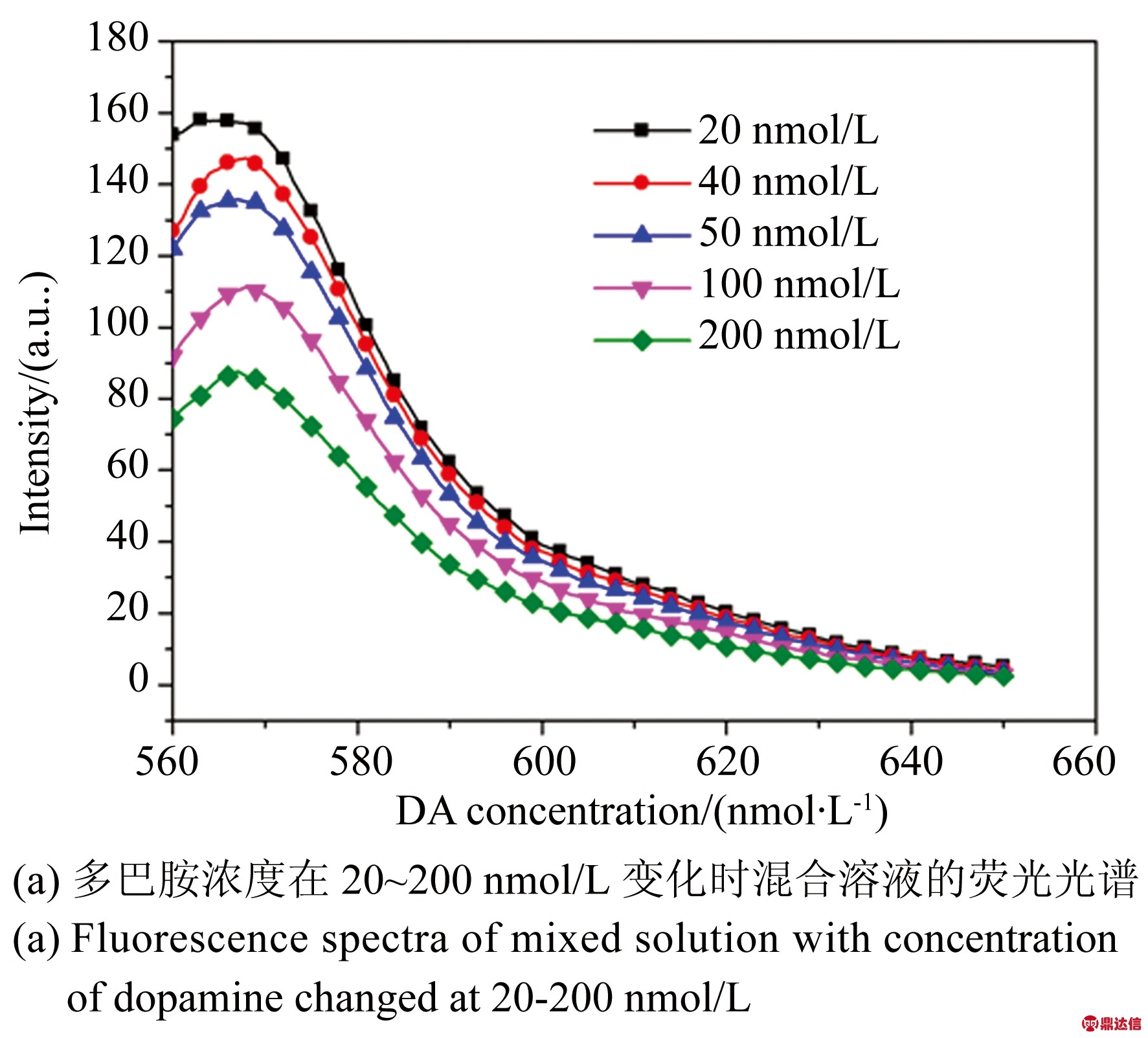
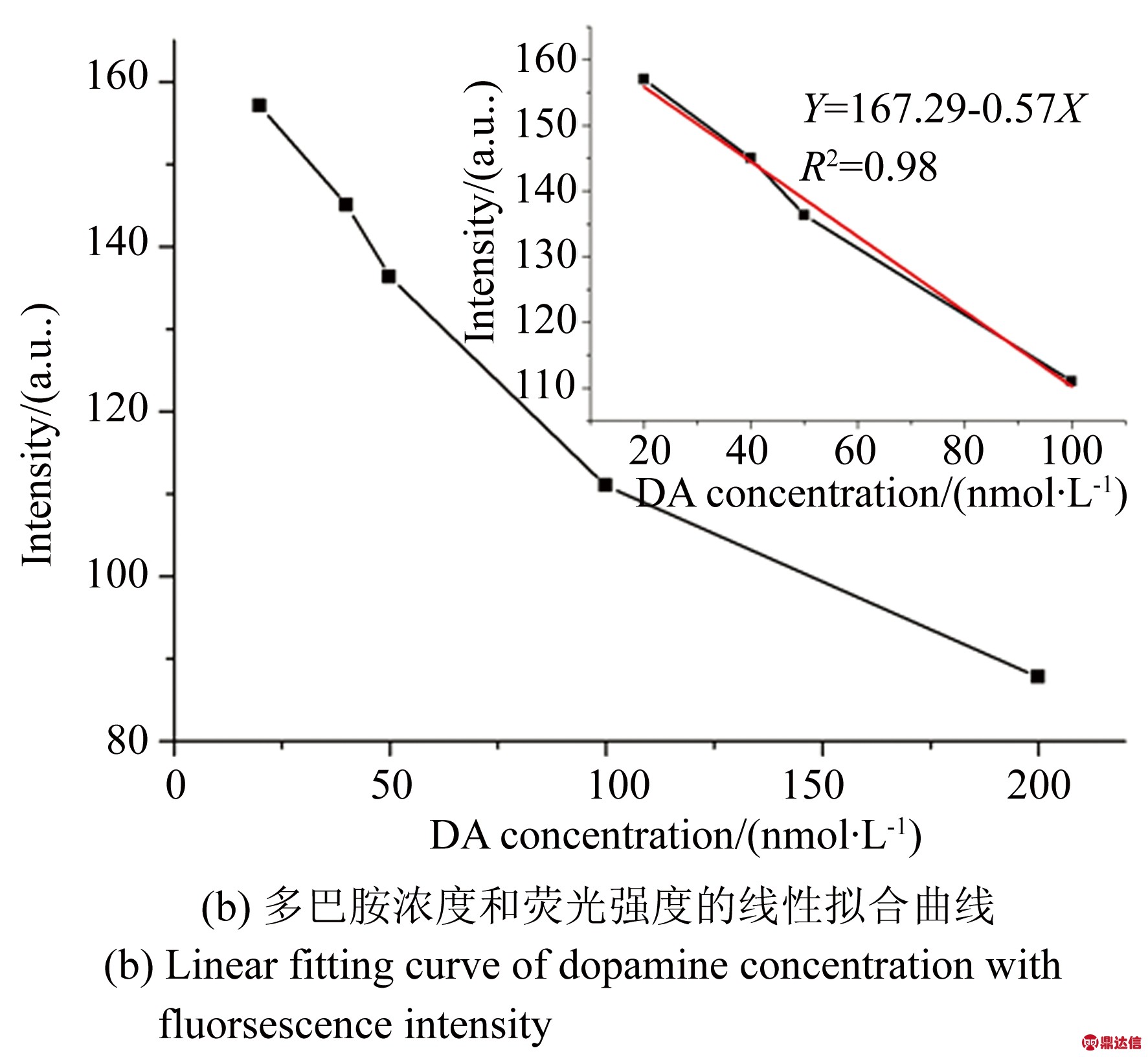
图5 多巴胺检测结果
Fig.5 Detection result of dopamine
4 结 论
本文基于贵金属纳米颗粒的金属增强荧光效应,在金纳米颗粒与核酸适体的浓度比为1∶5,且隔离层碱基A的数量为27的最佳实验条件下制备了一种具有荧光信号放大的生物传感器,放大倍数为2.35。该传感器能够有效检测多巴胺浓度,线性范围为20~100 nmol/L, 最低检测限为20 nmol/L。



