摘 要: 微/纳电子机械系统MEMS/NEMS(Micro/Nano Electro-Mechanical Systems)技术作为一种成熟的微结构制造技术,可实现硅基纳米级传感器器件的批量化、集成化制造,形成具有体积小、质量轻、性能高的微型传感器及其测试系统.生物传感技术可以将生物敏感反应信号转化为光电等信号而被检测.与其他生物传感器相比,采用MEMS/NEMS技术制备的生物传感器,灵敏度更高、响应时间更短、检测性能更强,更为实现自动化高通量的医学诊断提供了有力的支持.本文着重探讨MEMS/NEMS生物传感器常见的器件类型和对应器件的制备工艺、材料、传感机理、分类及其传感局限,通过综述MEMS/NEMS生物传感器及其国内外研究进展,最后总结MEMS/NEMS生物传感器关键的技术难点与重点,并展望未来MEMS/NEMS生物传感技术的发展前景以及存在的挑战.
关键词: MEMS/NEMS技术;生物传感技术;器件;传感机理;技术难点
1 引言
微电子机械系统MEMS(Micro-Electro-Mechanical Systems)[1]是在微电子技术(即半导体制造技术)的基础上发展形成的一种独立的微加工技术,其加工尺寸精度可以达到微米甚至纳米量级.纳电子机械系统NEMS(Nano-Electro-Mechanical System)是在MEMS技术的基础之上发展形成的一类超小型机电一体化的加工技术,其特征尺寸更小,可以达到亚纳米量级.在该尺寸量级下,易产生量子效应和界面效应;这种效应与光刻腐蚀、掩膜、掺杂、以及各向同性和各向异性蚀刻等微加工工艺融合,可使得器件更微型化、便捷式、高性能[2].
如今,随着数字信号处理和嵌入式智能技术的普及,基于MEMS的设备[3]已经成为一种复杂的微机电系统,并推动着信息通信技术、低功率集成电路、无线通信模块以及无线传感器网络向更高性能,更低功耗和更低成本发展.
由于市场潜力巨大,各类MEMS/NEMS器件的应用已经渗透到各个领域,从制造业到信息技术[4]、从生命科学到医疗健康.基于MEMS/NEMS技术的生物传感器,在医疗保健、环境监测和农业生产传感等方面表现极为突出.如基于MEMS的可穿戴式传感器[5]可感知人体的生命活动;基于MEMS的电容传感器[6]可监测心率、血压、血糖等疾病;基于电化学磁性微珠的传感器[7]可诊断和评估传染病;结合MEMS/NEMS技术的智能传感设备能够感知空气污染物的变化,实现实时高效的空气质量监督和预测[8];基于MEMS/NEMS的声传感器可通过二维声源定位昆虫飞行轨迹,实现有效的农药喷洒和农作物的防护,提高农产品的产量和质量.虽然基于MEMS/NEMS生物传感器已经取得了一定的成果,但其仍存在需要解决的关键技术难点,面临实际应用需求的挑战.
因此,本文首先阐述MEMS/NEMS生物传感器的加工工艺;再从器件的制备工艺、材料、传感机理、分类及其传感局限出发,重点综述常见的MEMS/NEMS传感器件及其在生物传感领域的研究进展;最后总结MEMS/NEMS生物传感器关键的技术难点与重点,并展望未来MEMS/NEMS生物传感技术的发展前景以及存在的挑战.
2 MEMS/NEMS生物传感器件加工工艺
MEMS/NEMS制造工艺[9]是指结构尺寸在微米到纳米尺度的加工工艺,主要包括光刻、剥离、刻蚀、氧化、扩散、注入、溅射、蒸馏、薄膜淀积等微加工技术.目前,该技术已成功实现将数百亿个晶体管集成于几英寸的硅片上[10].
通常,基底通过多次的离子束金属沉积、化学气相沉积、掺杂、或离子刻蚀等方法实现微/纳米尺度结构[11],再采用自组装技术,将生物材料以化学共价键或吸附的方式与微/纳器件结合形成特定功能的传感器件.
相比于传统的制造工艺,该技术构建的生物传感器成本低、产能高、体积小,可实现小尺度上的精准探测.同时易与IC工艺兼容,与执行单元、微能源、信号处理单元、微电子电路集成,构成具有传感、数据处理等功能的微型智能系统[12],为药物输送、环境监测、食品安全,以及疾病诊断提供新的解决方案.
3 MEMS/NEMS生物传感器分类及其应用研究进展
基于MEMS/NEMS加工工艺制备的传感器件,具有体积小、集成度高、重量轻、低功耗、响应快、谐振频率高等特点.该传感器件结合生物传感的原理如生物素-亲和素,DNA碱基互补配对等,将生物分子如酶、抗体、核酸、DNA等自组装形成具有针对性的微型生物传感器件.这些传感器可识别由敏感元件所引起的化学变化或物理变化,并实现生物化学信号向可易检测的信号转化,如电信号、光信号等.但基于不同的器件结构,其传感原理不同,信号的转化方式也有所差别.因而,可以大致分为微悬臂梁生物传感器、微电极生物传感器、微型声波谐振生物传感器、磁MEMS生物传感器、以及场效应晶体管生物传感器等.
3.1 微悬臂梁生物传感器
微悬臂梁生物传感器是一种以悬臂梁为转换器,将生物分子间化学反应转化成微/纳米尺度机械运动的装置.
一般地,硅基材料如硅、氧化硅、氮化硅等通过低压气相沉积、光刻、蚀刻、薄膜淀积、溅射等加工制备成微悬臂梁器件.其中,悬臂梁常被设计成矩形结构,且一端固定一端悬空,表面一侧采用自组装单层SAM(Self Assembled Monolayer)工艺进行功能化来固定对应功能的受体分子.引入检测目标后,则易被表面的受体分子捕获,这种结合会使悬臂梁产生应力[13]或改变其振动频率[14].因此,通过检测微悬臂梁表面的应力变化或者振动频率变化,可分析特定生物分子间的性质.
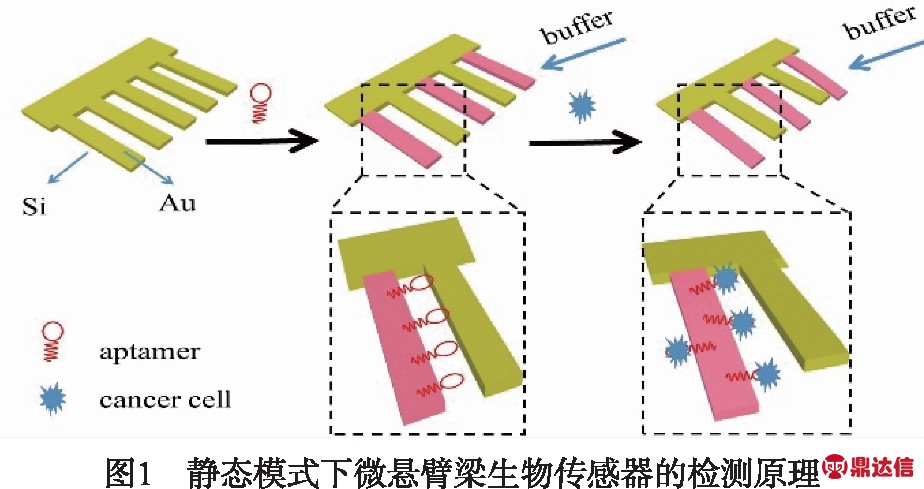
微悬臂梁生物传感器常见的工作模式有动态工作模式和静态工作模式.静态工作模式主要依据微悬臂梁表面的应力变化[15].图1为静态模式下,微悬臂梁阵列传感器的原理图,用适配体TLS11a修饰部分悬臂梁(粉色),其余(黄色)作为参照,观察微悬臂梁前后的挠度变化ΔX,实现对肝癌细胞HepG2实时检测.而动态模式下,微悬臂梁需要通过外部激励产生振动,当悬臂梁表面吸附生物材料时,会影响其弹性系数和阻尼系数,导致其振动幅度、谐振频率、品质因数发生改变[16].也就是说,可通过检测频率和品质因数的变化,对吸附物进行定量分析.此外,相比于静态模式,动态模式的检测灵敏度更高,可达到ag/mL[17],且适用于气相、液相状态.但是,在液态环境下,传感器由于受到阻尼运动而更难精确的测量[18].
目前,关于微悬臂梁生物传感的报道已有很多,但提升传感器的灵敏度仍然是面临的主要问题.通常,该类传感器的灵敏度会随其尺寸的减小或表面应力的增大而增大[19].并且,微悬臂梁器件的多阶谐振模态性质会影响谐振频率.因此,高阶模态下可获得更高的灵敏度.此外,在悬臂梁的自由端设计一个由内柱阵列组成的反应微腔,能有效地降低由生物吸附所引起的悬臂弹簧系数(刚度系数K)变化的影响,极大提高了捕获能力,检测限可达1ng/mL[20].同时,被证明改变传感表面的磁化性质,可增大悬臂梁偏转程度,可使输出信号有效扩大1000倍[21].
随着悬臂梁的设计结构和表面功能化方法的不断改进,以及制造工艺的不断提升,该类生物传感器会朝着更微型化、更灵敏、更便捷的方向发展,为化学气体、核苷酸、蛋白质、病毒细菌的检测提供了更加简便高效的方法.
3.2 微电极生物传感器
微电极生物传感器是一种以化学电极作为转换器,将化学反应转化成电信号的装置.
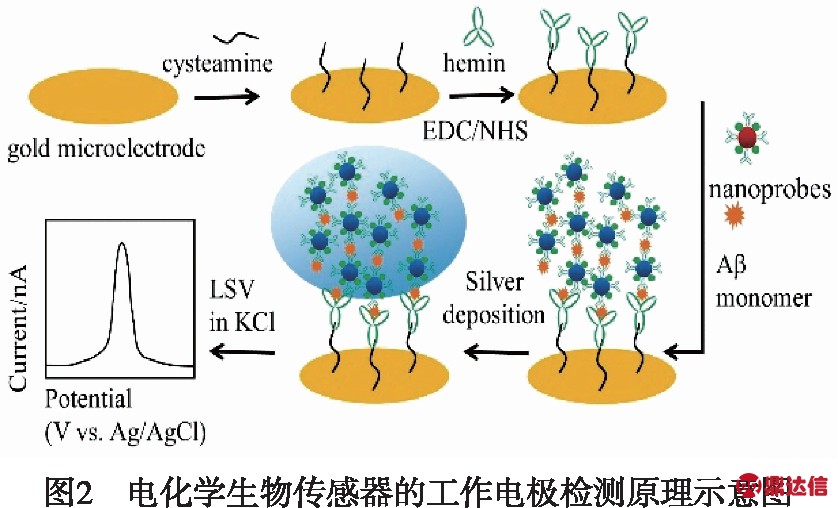
通常,采用电子束蒸发法在玻片衬底连续沉积形成导电金属层,再经过光刻、化学蚀刻工艺制备成一定图案形状的微电极[22].其中一类电极经微化加工阵列化后,可植入体内,进行药物输送,神经刺激,观察内部某些重要离子的变化[23].另一种微电极则是主要用于电化学分析中的单电极[24].通过对电极表面活化处理或电沉积,固定一类聚合物形成生物敏感膜来进行生物识别.如图2所示,电极表面采用自组装技术制备氯高铁血红素的生物敏感膜,以识别目标分子Aβ单体[25].由于探针和目标分子的引入,生成聚合物,并经过银沉积后,出现一个峰值信号.因此,微电极生物传感器可以将生成的物质识别并转化成电流信号.
近年来,基于微电极的生物传感器在传感性能得到了不断的提升.在结构设计上,电极更趋向于微型化、阵列化.原先的电极生物传感器只停留在单电极检测上,其响应速度和灵敏度都有一定的局限,很难实现快速准确的检测.而阵列化则很大程度上弥补了这个缺陷,增大了比表面积,提高了检测信号.Triroj等人[26]证明由辅助聚焦离子束铣削和蚀刻技术制备的纳米尺度电极阵列,可提高两个数量级电流密度,检测限高达10pg/mL(270fM).
在检测体系上,微电极生物传感器易于与CMOS检测电路集成,形成片上微系统.Tedjo等人[27]已证明高密度微电极阵列的CMOS微芯片,可实现16064个通道读取,其灵敏度相比较于同一类物质的检测,提高了100倍.
然而,生物相容性是集成检测系统与生物传感相融合时必须要考虑的问题.由于CMOS电子器件材料是独立于生物传感器制备的,当二者集成于同一硅片时,CMOS器件材料可能会对微电极上的生物检测造成干扰.并且,电化学反应通常发生在液-固界面上,提高界面的生物相容性能有效地提高传感器的检测灵敏度.
目前,基于微电极的生物传感器已经从单一电极检测发展为阵列化集成芯片检测模式.尽管在结构设计、响应时间、生物相容性等方面仍然存在一定的缺陷,随着MEMS/NEMS加工技术的不断改革,未来的微电极体积更小、传输性能更强、灵敏度更高、制造成本更低、且与生物兼容性更强.同时,更多柔性材料和表面修饰技术的创新,进一步推动新型微电极生物传感器的研制,为今后植入式、可穿戴式柔性传感提供更加稳定可靠、更高时空分辨率的化学检测手段[28].
3.3 微型声波谐振生物传感器
微型声波谐振生物传感器是一种以声波谐振器为转换器,通过检测声波特性变化如声波速度和共振频率来实现生物识别的装置.
声波谐振器可根据声波的传播方式分成表面声波谐振器SAW(Surface Acoustic Wave)和体声波谐振器BAW(Bulk Acoustic Wave).
石英晶体、铌酸锂、钽酸锂等压电材料常作为SAW谐振器的基底,在基底表面通过光刻技术和沉积技术制备叉指结构的金属电极交错换能器IDTs(Inter-Digitated Transducers)和压电薄膜[29].如图3(a)所示,在薄膜中间表面利用自组装技术构建生物敏感层,当输入一个正弦电压时,输入端的换能器通过逆压电效应将输入的电信号转化为声信号,并沿薄膜表面传播.如果待测物与敏感层表面的抗体结合时,会使声波传播产生时滞,导致谐振频率降低.
薄膜体声谐振器FBAR(Film Bulk Acoustic Resonators)是最常见的BAW谐振器.一般地,可通过化学气相沉积法制备器件支撑层,并利用掩膜工艺和光刻技术对底电极和顶电极进行金属沉积,再用射频磁控溅射法制备压电薄膜[30].其传感原理和SAW类似,当分析物与传感层相互作用时,附加的质量载荷会致使薄膜发生机械形变,使共振频率漂移[31].
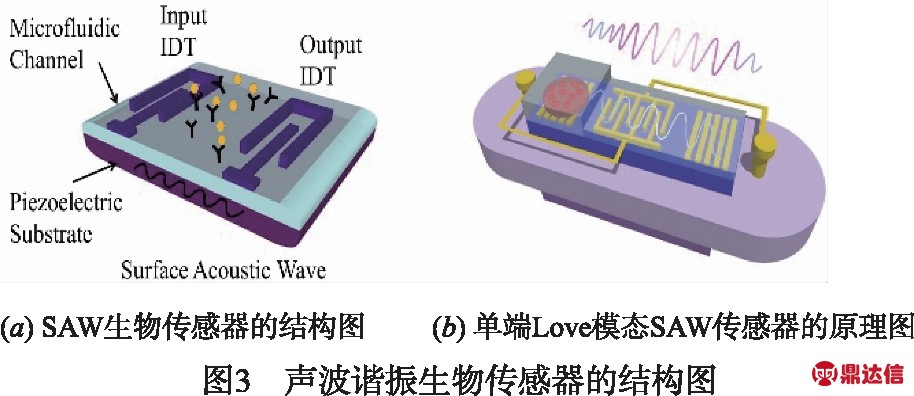
MEMS加工技术的引入,将微型机械和生物传感系统更好地集成于单个硅基板上,以提高灵敏度.Chen等人[32]集成了一种单端口Love模式的SAW生物传感器.其结构如图3(b)所示,在铌酸锂晶片表面,采用标准光刻技术制备IDTs,两侧设计了100个反射光栅,最后离子体增强化学气相沉积技术沉积SiO2薄膜,实现Love波模式.与石英晶体微天平相比,该设备的信噪比明显增强,其频移从8960kHz增加至10368kHz.
此外,传感器常被置于液相复杂环境中,其传感性能会受到液体阻尼的影响而下降,剪切模态AIN-FBAR生物传感器的声波能量在液相环境中耗散低[31],能保持较高的Q值,其检测限可以达到0.3ng/cm2[33].该装置可嵌入微流控系统,允许生物溶液在微流腔内输送,实现高通量多通道精准检测.
未来,这种表面和体声波谐振生物传感器将与无线传输技术[29]以及CMOS技术相融合,使系统更便捷,更低功率,实现远程监测.
3.4 磁MEMS/NEMS生物传感器
磁MEMS/NEMS生物传感器是一种以磁性器件为转换器,通过检测磁场变化来实现生物识别的传感装置.
常见磁性传感器有谐振线圈传感器[34]、磁通门传感器[35]、霍尔传感器[36]、各向异性磁阻传感器[37]等,其中巨磁阻抗GMI(Giant Magneto-Impedance)传感器[38]由于体积小、响应快、稳定性好等特点而被广泛的应用于生物传感领域.巨磁阻抗传感器常选用硅或玻璃作为基板,利用射频溅射系统沉积一层金属层如Cu、Au、Cr,再进过电镀、光刻、蚀刻、抛光等形成磁性电极[39].
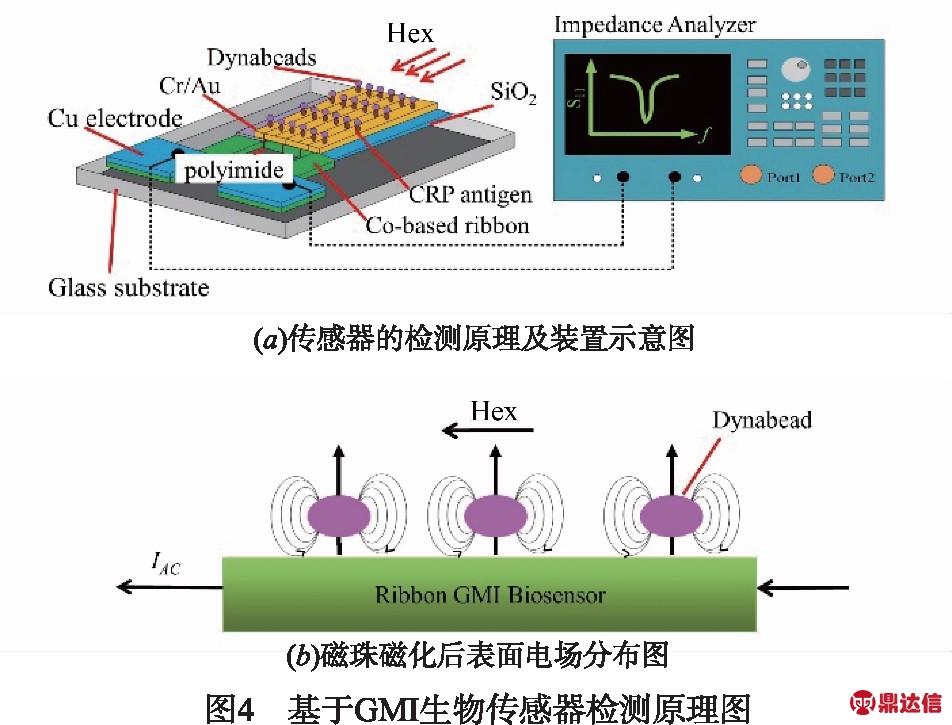
超顺磁性粒子如磁珠[40]和磁纳米颗粒[41]常被作为固相生物载体,与磁传感器共同用于免疫检测、磁共振成像、核酸分离等.通常,超顺磁性粒子只有当外加磁场作用下才会被磁化[40].如图4(a)所示,直流电源驱动生成纵向外磁场Hex,当由磁珠标记的C反应蛋白CRP(C-Reactive Protein)被表面的抗体捕获时,磁珠由于受到外磁场的作用而产生杂散磁场(图4(b)),引起巨磁阻抗GMI效应[40],改变传感器的磁阻抗[42].因此,通过检测磁阻抗的变化可准确识别生物个体.
超顺磁性粒子磁标技术已成功实现对生物分子的传输、分离和检测[43],但仍有一定的局限.当被标记的生物分子密度过高时,磁性颗粒之间的磁场会相互抵消,削弱了对传感器本身磁性的影响,导致无法准确识别[40].此外,在检测过程中,由于检测平台尺寸过大,磁性颗粒扩散距离过长,使得响应时间过长[44].适当缩短扩散距离,实现快速可控的响应是设计磁生物传感器的关键.
近年来,微流体技术[45]在生物检测中展现出试剂消耗低、效率高、自动化等优势[46].该技术可将待测液通过注射泵输送到传感区域进行识别检测,有效缩短了扩散距离,降低废物的生成,提高分子捕获率.
另外,微流体技术与磁免疫分析技术结合,可实现多区域生物分析系统,为多标志物实时检测POCt(Point-Of-Care Test)提供了广阔的平台.Gao等人[47]将GMR传感器、微流控磁纳米颗粒标签、双抗体夹心免疫法集成于一体,并能在15min内完成同时检测12种肿瘤标志物.
综上所述,进一步提高磁性传感器的灵敏度是未来研究的关键.目前,磁MEMS生物传感器已成功和微流体技术集成,并在POCT诊断中展现出广阔的应用前景.另外,通过进一步优化MEMS/NEMS微加工技术和改用更高性能的磁性材料,可有效地提高分子捕获效率,实现高度灵敏、高通量的检测.
3.5 场效应晶体管生物传感器
场效应晶体管FET(Field Effect Transistors)生物传感器是一种以场效应管为转换器,将生物识别系统中的化学或物理信号转化成电学信号的装置.
通常,在硅基表面通过化学腐蚀和热氧化形成一层氧化硅,然后再通过射频磁控溅射法沉积金属电极作为源极和漏极.而栅极则选用具有高迁移率的材料,如纳米材料.常见的纳米材料有硅基材料(硅纳米线[48])和碳基材料(石墨烯[49],碳纳米管[50]).
在典型的FET生物传感系统中,传感元件如抗体、DNA、酶等,被固定在连接源-漏极的半导体通道上.同时在栅极施加偏置电压,通过捕获带电目标分子,来改变通道内的电导.根据通道中主导载流子的类型可将其分为N型场效应晶体管和P型场效应晶体管[51].如图5所示,由于N型管中多数载流子为携带负电荷的电子,当携带负电荷的目标分子被通道中的受体捕获时,堆积在表面的负电荷会排斥通道中的电子,使得电导降低.而P型管则正好与之相反[52].
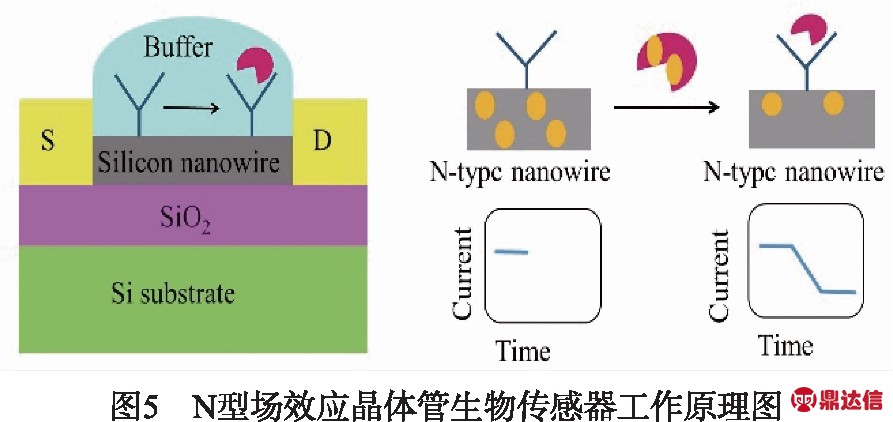
在构建场效应管生物传感系统时,必须考虑以下几个关键的因素:
(1)传感元件的材料.场效应管在生物检测过程中,主要依靠载流子的移动实现信号传输,高迁移率、大比表面积、生物相容强的材料[48],可敏锐感知信号的变化,并将其快速有效的输出[53].
(2)检测的离子浓度.由于德拜屏蔽效应的影响,当检测离子浓度过高时,德拜长度之外的带电分子会被分析物的静电作用而屏蔽,即德拜长度之外的分子就不会引起电导率变化[54].但是,浓度过低又会导致信号过小而难以被转化,导致无法有效识别.
(3)传感器通道结构尺寸.在纳米材料场效应管传感中,纳米尺寸结构可促使带电分析物更快地消耗通道载流子,提高传感器的灵敏度.3D结构的硅纳米线阵列通道相比较于单通道和双通道,可实现多通道信号并行处理,其灵敏度可达到5fM[55].蜂窝状的纳米线结构可有效增大比表面积,并在极低的溶液中表现出很高的灵敏度,其检测限低至5pg/mL[56].
未来,场效应管生物传感器将突破材料、尺寸、浓度等局限,研制新型传感结构,开发新型纳米材料,优化传感性能,提高传感器灵敏度.此外,还应着重探究生物识别特性,优化探针密度,增强信号转化能力,克服液相环境中的屏蔽效应.
4 总结
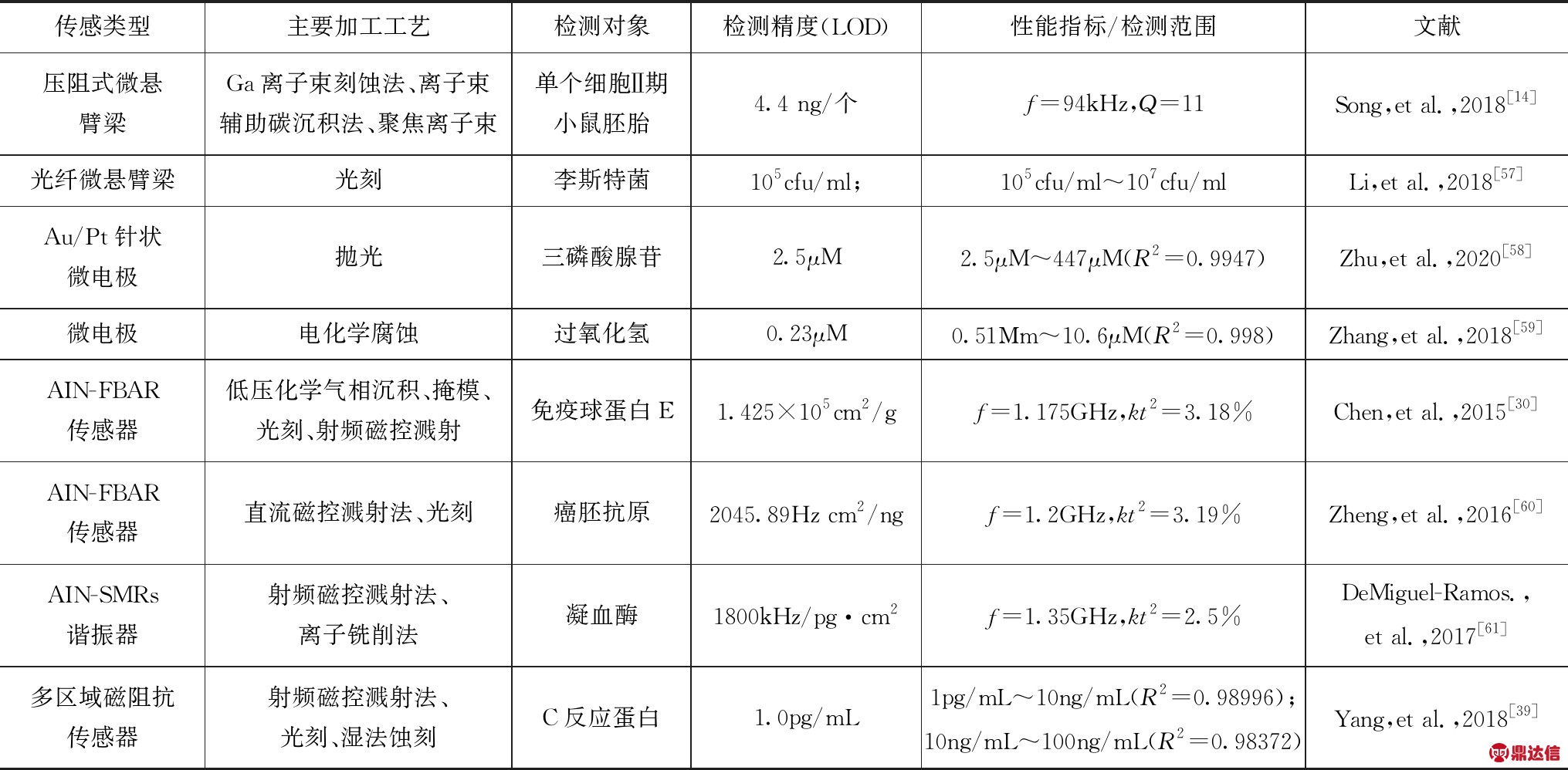
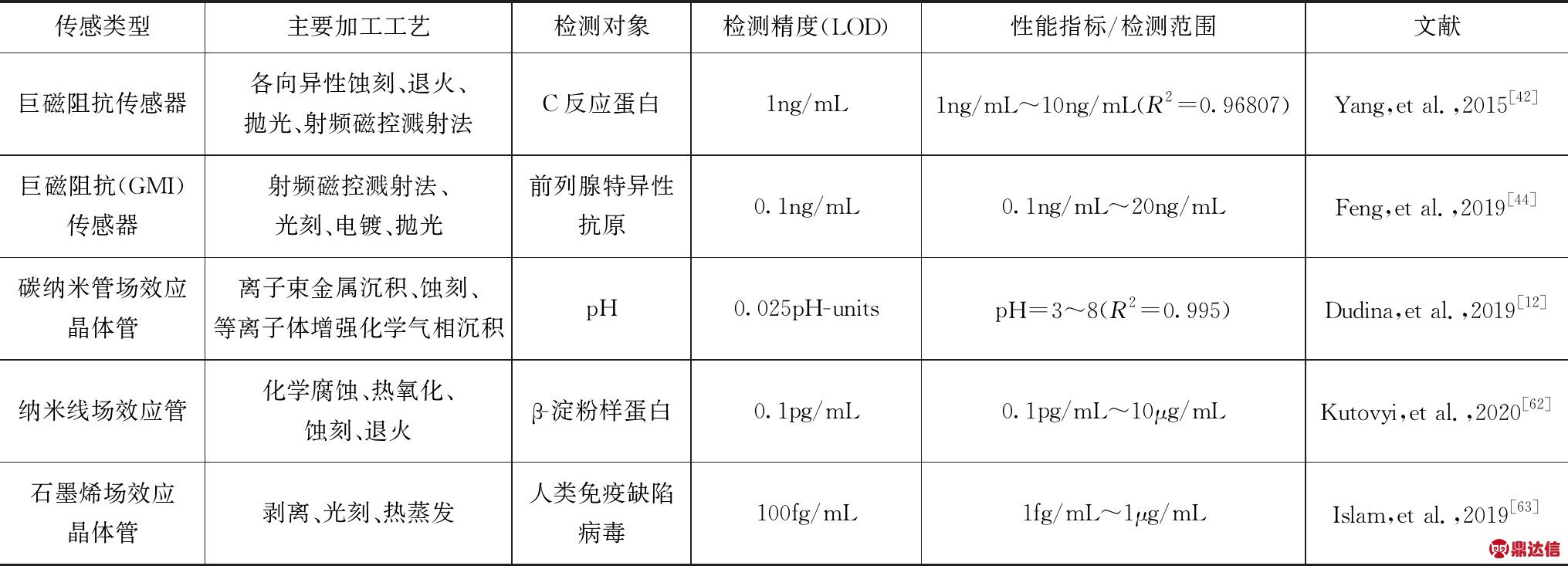
表1总结了近几年各类MEMS/NEMS传感器在生物传感领域的研究成果.在加工工艺上,光刻技术可有效地将电路图形转移到衬底的表面,而常用于各种电极制备;射频磁控溅射法因常于薄膜制备而广泛应用于磁阻抗传感器和声波谐振器的制备中.在生物传感应用上,微型化的MEMS器件已成功实现对蛋白质、酶、离子、pH、病毒、细胞等分子的有效检测.但是当该技术与生物传感技术相结合时,仍然存在一些亟待突破的问题:
表1 各类MEMS传感器件在生物领域中的研究应用对比
续表
(1)界面相容性.生物分子通常以液态的形式与固态的传感界面接触,并在固-液界面发生物理吸附或化学变化.但是,当生物分子不能很好地固定在界面时,传感装置则会过滤掉这种变化,无法实现有效的信号转换.
(2)传感器的可重复性.在生物检测过程中,传感元件经过自主装后形成特定功能的生物敏感层,以实现对特定分子的识别.但是这些分子一旦被固定在传感元件表面时,却很难通过物理化学的方法来去除,使得传感元件的可重复性降低,成本升高.
(3)高通量高灵敏检测.目前,MEMS/NEMS生物传感器与微流体技术、COMS技术相结合,形成片上检测微系统.这种检测方式,大大降低了环境噪声的影响,提高了检测性能.尽管GMR传感器已验证可同时检测12种肿瘤标志物,但是灵敏度最低只有0.1ng/mL.因此,实现高通量高灵敏检测是未来生物传感商业化的关键.
5 结论和展望
基于MEMS/NEMS技术生产的器件具有体积小、重量轻、性能好、成本低等特点.目前,微悬臂梁生物传感器趋向于微型化,并成功实现单个细胞检测;微电极生物传感器更趋向于阵列化集成芯片检测,对蛋白质类物质检测的灵敏度可达到fM量级;微型声波谐振生物传感器则结合微流控系统,趋向高通量多通道精准检测,对蛋白质类物质其检测限可达ng/mL;磁MEMS/NEMS生物传感器与微流体技术结合,构建多标志物实时检测平台,已成功实现12种肿瘤标志物同时检测;场效应晶体管生物传感器结合CMOS技术改善栅极材料,优化传感性能,对DNA类物质可实现fM量级的检测.
随着物联网和云计算的飞速发展,MEMS/NEMS技术成本逐渐下降,传感器的存储和数据将变得可视化,人们对个人健康管理和环境监测的需求日益增长,将进一步推动更高选择性高灵敏度MEMS/NEMS传感器件的研制.未来的MEMS/NEMS生物传感器件将会更加人性化和便捷化,并支持智能设备(如手机)的连接,通过“大数据”实现数据的存储和反馈,来监测个人的各项健康指标以及各类疾病的诊治,实现一个多传感多模态的智能生态系统.



