摘 要:【目的】真空渗透法无需组培过程,可明显缩短转化周期,提高转化效率。文章建立了水稻的真空渗透转化体系。【方法】应用自主研制的真空渗透转化装置,对开花前的活体水稻进行短暂抽真空条件下的农杆菌侵染,快速将苦参凝集素蛋白基因(SFL)成功转入水稻。【结果】对大量T0代转化种子进行除草剂抗性筛选、氯酚红和PCR检测,获得一批转基因阳性苗,证明外源基因已整合到水稻基因组中;经苗期喷雾接种和田间人工诱发鉴定,与非转基因对照相比,最终筛选出抗性明显增强的转SFL基因水稻材料,证明SFL基因在水稻中得到表达。【结论】本研究为水稻及其它作物的基因转化提供了一条快速、有效的新途径,同时也为SFL基因的功能研究及抗稻瘟病水稻新品种的培育奠定了基础。
关键词:真空渗透法;苦参凝集素蛋白基因;稻瘟病;水稻
【研究意义】水稻(Oryza sativa L.)是重要的粮食作物之一,是全球1/2以上人口的主食。稻瘟病是水稻上危害最严重的真菌病害,严重威胁着水稻的高产、稳产[1]。尤其云南省等西南粳稻生产区,每年稻瘟病发生面积都在133.3万hm2以上,所造成的产量损失非常惨重[2]。使用化学农药虽然在一定程度上可控制该病害,但增加了农民的生产成本,而且带来了严重的环境污染和生态失衡等问题。转基因技术能突破生物种间障碍,实现物种间基因的转移,为水稻的抗病育种带来了新契机。利用转基因技术将抗稻瘟病基因导入栽培稻,培育高抗性品种,是目前防控该病害最经济、有效和安全的途径。【前人研究进展】水稻转基因抗病育种成功与否,很大程度上依赖于有效的遗传转化方法的开发和应用。目前水稻的转基因方法以农杆菌介导法为主,利用该方法已成功获得了一些优良的抗病虫转基因水稻材料[3-8]。然而该转化法主要依赖受体细胞的脱分化和再分化过程获得转基因植株,明显地存在操作繁琐且周期长、易发生体细胞变异、转化植株常出现基因沉默、转化效率低等缺陷[9-12],这无疑是通过基因转化进行水稻品种改良和功能基因组研究的极大障碍。真空渗透法(Vacuum infiltration)是一种无需经过组织培养,只需对开花早期的活体植株抽真空处理即可直接获得转化种子的原位转基因方法。与传统的农杆菌介导法相比,该方法具有简便、快速、可靠、高效等优点,为水稻等植物的基因转化开辟了新途径[11-13]。自1993年Bechtold等首次利用该法在拟南芥中成功转化以来,随后该方法在矮牵牛、豆科植物、棉花、白菜、芥菜、萝卜、烟草、油菜、猕猴桃等多种植物上也实现了成功转化[14-27]。此外,水稻的抗稻瘟病育种还面临稻瘟病菌变异快、现有栽培稻抗源面窄和优良抗源少等难题,从稻属以外的生物中发掘新的抗稻瘟病基因具有重要意义。【本研究切入点】课题组前期从苦参块根中分离克隆到一种对水稻稻瘟病菌(Piricularia oryzae Cav.)具有明显抑制作用的凝集素蛋白(Sophora flavescens Lectin,SFL)基因[28],该基因的表达可以提高水稻对稻瘟病的抵御能力,可作为一个新的抗稻瘟病基因源进行发掘和利用。真空渗透法无需组培过程,具有简便、快速、高效等优点,但目前该法在水稻遗传转化上的应用研究未见报道。【拟解决的关键问题】首次应用真空渗透法,将苦参凝集素蛋白基因SFL转入云南粳稻品种‘云资粳41号’,获得抗稻瘟病能力提高转SFL基因水稻材料,建立水稻的农杆菌-真空渗透转化体系,为水稻等作物的基因转化提供了一条快速、有效的新途径,同时也为今后SFL基因的功能研究及抗稻瘟病水稻新品种的培育奠定了基础。
1 材料与方法
1.1 受体材料
水稻受体品种为云南粳稻品种‘云资粳41号’,该品种是元江普通野生稻与栽培稻‘合系35’的杂交后代,具有大穗、着粒密度高、粒宽、株型好等特性,但是抗稻瘟病能力较差。根据预定的转化时间,提前在温室进行生长状态较佳、健壮的待转化水稻受体材料的分批培养。将‘云资粳41号’种子浸种5 h后,直接播种于装有水稻土的培养桶内,出苗后进行壮苗30~40 d,再分栽于装有适量水稻土的培养桶内培养50~60 d,待长至抽穗期便可直接取用进行转化。
1.2 质粒、菌株及真空装置
含目的基因的表达载体质粒pCAMBIA1300-SFL(bar)为本实验室构建和保存,选择标记基因为bar基因。农杆菌LBA4404为本实验室保存。云南稻瘟病菌生理小种16t由云南农业大学李成云教授惠赠。
真空渗透装置为自主研制的水稻真空渗透转化装置(详见国家发明专利 “一种水稻遗传转化真空渗透转化装置”专利号:ZL201410467839.6)以及津腾GM-0.33B隔膜真空泵等。
1.3 真空渗透转化及转化子筛选
1.3.1 农杆菌渗透转化液的制备 将保存的农杆菌菌液划线接种于含相应抗生素的YEP 平板上,28 ℃培养24~48 h。挑取长出的单菌落接种于含相应抗生素的10 mL YEP 液体培养基中,28 ℃,200 r/min振荡培养48 h,然后将菌液转入 2 L 不含抗生素的 YEP 培养基中,继续培养至 OD600为1.0左右,室温下4000 r/min离心5 min,收集菌体,菌体用渗透培养液(1/2MS液体培养基+ As 19.6 mg/L+ Silwet L-77200 μl/L +蔗糖50 g/L,pH 5.8)重悬调节OD600为0.8,作为含目的基因的农杆菌渗透转化液备用。
1.3.2 真空渗透转化及栽培管理 提前将待转化水稻植株培养桶内的水沥干,用袋子把植株和土进行包裹,以防土渗漏。留下适宜转化期的水稻分蘖枝,其余分蘖全部剪除;装置的固定、连接和密封具体参照国家发明专利 “一种水稻遗传转化真空渗透转化装置”(专利号:ZL201410467839.6)中的相关描述;将水稻连同培养桶整个倒置在容器的环状承接台上,使植株稻穗自然下垂;将转化液置于真空渗透装置中;调节转化液盛放器的高度使植株的花序部分完全浸于含菌体的渗透培养液中;盖上容器顶盖,关闭排气阀,将真空泵上的真空管和进气阀连接,打开真空泵开关,抽真空。0.05 MPa,维持10 min,转化完成,立即关闭真空泵开关,缓慢打开阀门,待容器恢复常压,打开盖板,取出植株。
将转化后的水稻植株置于温室,覆膜保湿2~3 d后,按常规栽培方法继续培育植株至成熟(约30~40 d),收获T0代转化种子,干燥后保存备用。
1.3.3 抗性转化株的筛选 进行不同浓度的受体材料Basta喷施实验,确定转化子的最佳筛选浓度。3次喷洒确定浓度的除草剂 Basta(phosphinotricin,原液浓度为10 %)水溶液以筛选抗性株:将收获的T0 代种子,播种在盆钵中,每盆约播种100 粒。出苗后,常规管理,待幼苗生长到子叶完全展开时开始第1次喷洒,5~7 d后第2次喷洒,再过5~7 d后第3次喷洒,最后存活的植株定为抗性株。统计抗性株数,按公式(1)计算转化率:
转化率(%)=抗性株数/T0代种子数×100
(1)
1.4 抗性株的检测以及抗性鉴定
1.4.1 抗性株的氯酚红检测 以未做转化的‘云资粳41号’植株为对照,从利用 Basta 鉴定筛选出的抗性株中,随机挑出部分转化株,剪取叶片放置于氯酚红反应液(MS + 15 μmol/L 6-BA + 0.5 μmol/L NAA + 50 mg/L CR + 5.0 mg/L PPT,pH值 6.0)中,28 ℃暗培养3~5 d后观察颜色变化。
1.4.2 抗性株的PCR检测 采用 CTAB 法提取部分抗性株幼嫩叶片的基因组 DNA,以ddH2O为空白对照,非转化植株为阴性对照,以pCAMBIA-SFL(bar)质粒为阳性对照,进行外源基因(SFL)和标记基因(bar)的PCR扩增鉴定,PCR检测目的基因的整合情况。SFL基因上游引物SFL-1(5’-AACCCAA AGTCATAGTTGCAT-3’)和下游引物SFL-2(5’-GCTCTACACCATGGATAACT-3’);Bar基因引物上游引物Bar-1(5’-CCGCTCGAGGATCTACCATGAGCCCAGAAC-3’)和下游引物Bar-2(5’-CCGCTCGAGCGGGTCATCAGATCTCGGTGA -3’)。PCR扩增体系为25 μl:ddH2O 15.75 μl,DNA 1 μl,10 mmoL/L引物各1 μl,10×PCR buffer 2.5 μl,dNTP (2.5 mmol/L) 2 μl,MgCl2 (25 mmol/L)1.5 μl,rTaq DNA聚合酶(5 U/μl)0.25 μl。PCR 扩增程序为:95 ℃ 预变性 5 min; 94 ℃ 变性 45 s,48 ℃(SFL)或53 ℃(Bar)退火 45 s,72 ℃延伸1.5 min,共35个循环;72 ℃延伸10 min。PCR扩增产物用1 %琼脂糖凝胶电泳检测。
1.4.3 转基因植株的抗稻瘟病鉴定 稻瘟病菌产孢:先将活化的稻瘟病菌丝接种于PDA液体培养基中(土豆200 g/L+葡萄糖40 g/L,pH 5.8), 25~28 ℃培养4~5 d后,吸取适量菌液均匀地涂布接种于番茄燕麦培养基上(燕麦片40 g/L+番茄汁200 mL/L+CaCO3 0.6 g/L+琼脂18 g/L,pH 5.8),25~28 ℃,弱光下进行产孢培养7~10 d。
稻瘟病菌苗期喷雾接种:将所有鉴定材料浸种、催芽后播于装有水稻土的育苗盘中,每个材料2 次重复。当苗龄达3 叶1心期时,制备浓度为2×105个/mL的孢子悬浮液,加1滴吐温20作展布剂,进行喷雾接种。接种后置于25~28 ℃,保湿以利于发病,7~10 d 后调查发病情况。以非转基因水稻和易感蒙古稻作为对照,病情鉴定的方法按国际水稻所公布的抗性分级标准进行。
稻瘟病菌大田人工诱发鉴定:在隔离基地田间种植苗期抗病的T2代材料,用当地稻瘟病高发田块中采集的感病株进行稻瘟病诱发鉴定,四周种植感病品种蒙古稻,7~10 d左右调查发病情况,病情鉴定的方法按国际水稻所公布的抗性分级标准进行。
2 结果与分析
2.1 水稻的真空渗透转化
本研究应用自主研制的水稻真空容器,以含SFL基因的pCAMBIA-SFL(bar) 表达载体作为外源片段,取用生长健壮的抽穗期‘云资粳41号’活体水稻植株作为受体,0.05 Mpa条件下抽真空10 min即实现了外源SFL基因向受体水稻植株的原位转化(图1)。共计处理水稻受体10株,每株平均3个分蘖枝,收获T0代种子12 650粒。

图1 正在进行真空渗透转化的水稻受体植株
Fig.1 The recipient rice plant in situ undergoing vacuum infiltration transformation

图2 部分转化株的除草剂抗性筛选结果
Fig.2 The screening results of herbicide resistance of the partial transformed plants
2.2 抗性转化株的筛选
根据受体材料对不同浓度的除草剂Basta的喷施反应(图2上),确定转化子的筛选浓度为20 mg/L,部分转化株的除草剂喷施实验结果如图2下所示,非抗性株在喷药后 2~3 d,叶片便开始枯萎,后来整个植株枯死。抗性株由于有bar基因的表达产物,能够分解 PPT 而除去毒性,生长照常不受影响。通过除草剂喷施实验共筛选获得135株抗性苗,平均抗性苗为13~14苗/株。
2.3 转基因植株的检测以及抗性鉴定
2.3.1 抗性株的氯酚红检测 对除草剂抗性株进行氯酚红检测,通过颜色的反应可初步判定是否为阳性转基因植株。部分转化株的氯酚红鉴定结果表明,转基因抗性植株因为有bar基因的表达,能够分解 PPT,没有影响离子的代谢,因呼吸作用产生二氧化碳,导致 pH 值下降,颜色由红变为黄色或者橙黄色;非转化株则不同,由于不能分解 PPT 而代谢出氨,导致 pH 值升高,颜色不变或者由红色变为紫红色(图3)。经统计,135株除草剂抗性苗中,氯酚红阳性株为116株。氯酚红检测法操作快速简便,观测结果直观,可在早期对转基因植株进行初筛,大大节约筛选成本并且提高效率。
2.3.2 抗性株的PCR鉴定 对经氯酚红检测的抗性株进行PCR检测以确认目的基因是否转入受体植株。部分抗性株的PCR扩增检测结果表明,抗性转化株中可扩增出与pCAMBIA-SFL(bar)质粒相同大小的1000 bp左右的SFL基因片段和560 bp左右的bar基因片段,而未转化阴性对照则无扩增条带(图4和5),表明外源DNA已整合到转化植株基因组中。经氯酚红检测的116株阳性苗中,经PCR检测,还是存在一定数量比例的假阳性苗(图4上)。说明氯酚红检测法存在一定的局限性,只适于早期对转基因苗进行初步鉴定。相比之下,PCR检测结果更准确可靠。本研究收获的12 650粒T0代种子中,最终经PCR检测确定的转基因阳性苗为98株,转化率为0.77 %。

1:氯酚红反应液;2~3:非转基因植株叶片;4~9:转SFL基因植株的叶片
1: Chlorophenol red reaction solution; 2-3: Non-transgenic plant leaves; 4-9:Transgenic leaves of SFL gene plants
图3 部分转基因植株叶片的氯酚红显色鉴定
Fig.3 Identification of chlorophenol red in leaves of some transgenic plants
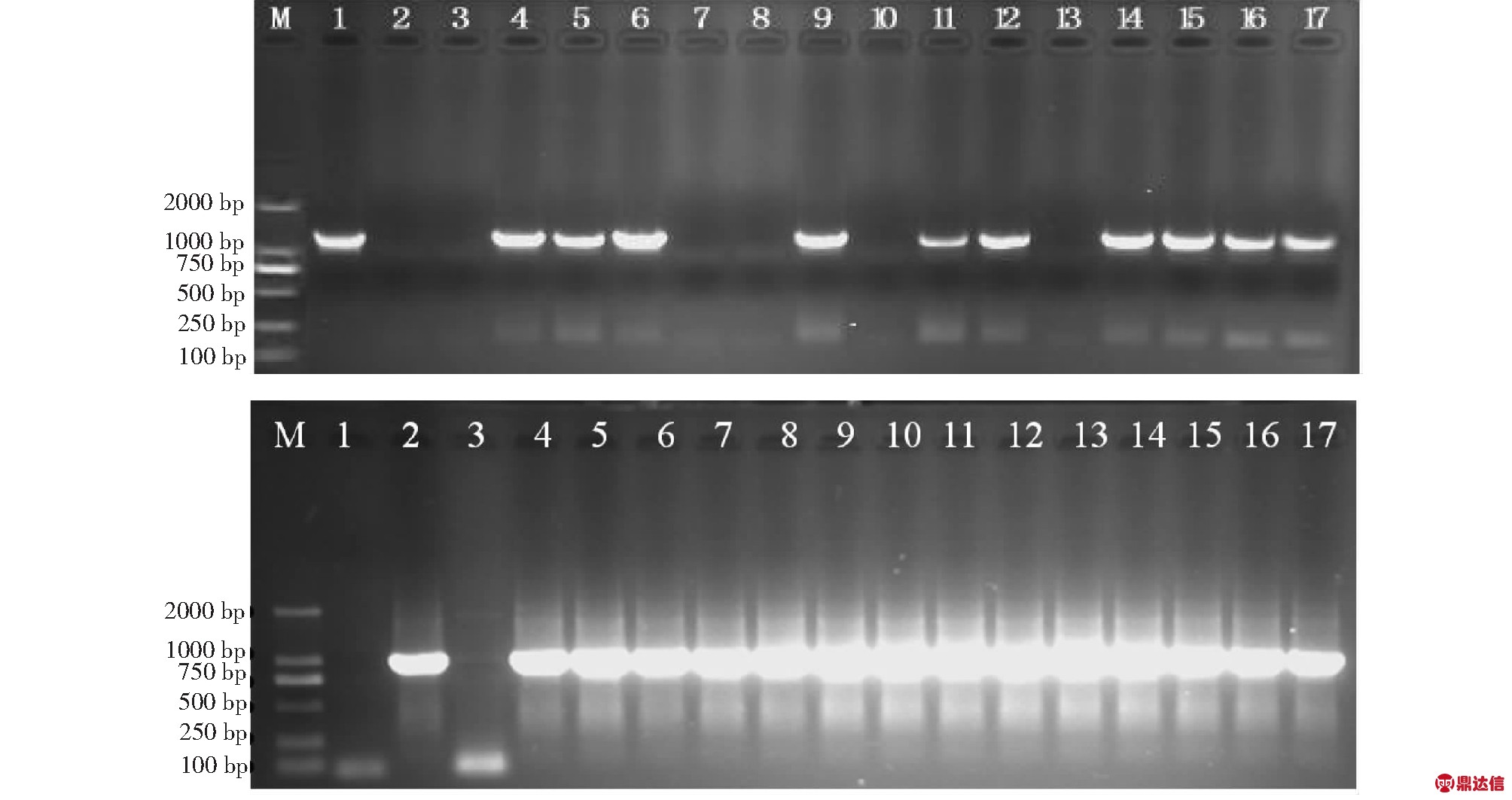
上-M: DL2000; 1: 阳性对照; 2:H2O空白对照;3:阴性对照;4~17:转基因植株; 下-M: DL2000; 1:H2O空白对照;2:阳性对照;3:阴性对照;4~17:转基因植株
Above-M:DL2000; 1:Positive control; 2:H2O blank control; 3: Negative control; 4-17:Transgenic plants; Below-M:DL2000; 1: H2O blank control; 2:Positive control; 3:Negative control; 4-17: Transgenic plants
图4 部分转基因植株SFL基因PCR检测电泳图
Fig.4 Electrophoretogram of SFL gene in some transgenic plan
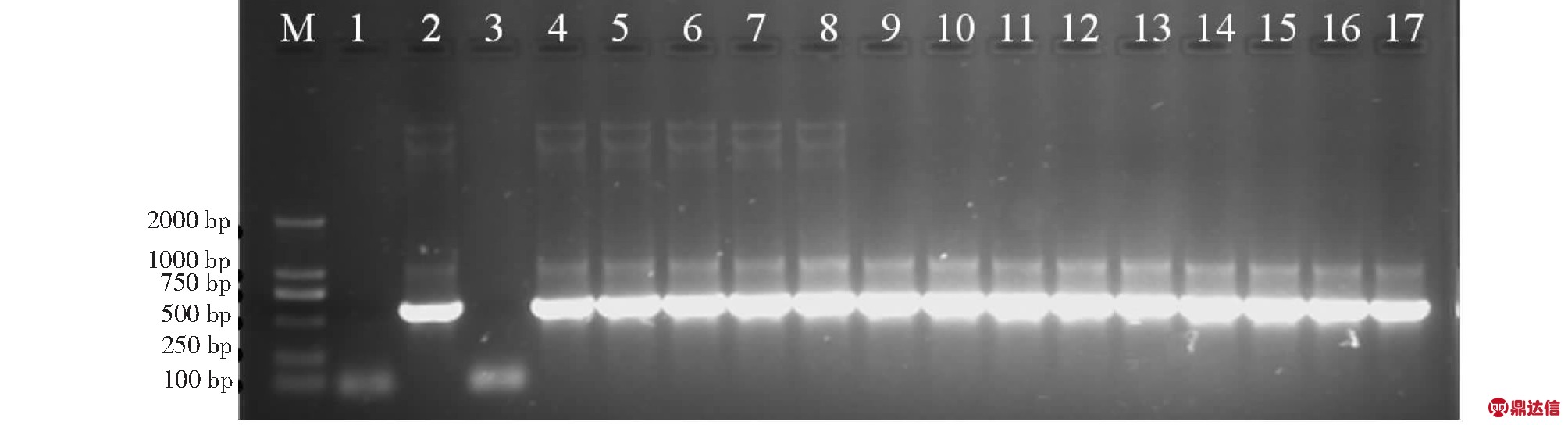
M:DL2000; 1:H2O空白对照;2:阳性对照;3:阴性对照;4~17:转基因植株
M:DL2000; 1:H2O blank control; 2:Positive control; 3:Negative control; 4-17:Transgenic plants
图5 部分转基因植株bar基因PCR检测电泳图
Fig.5 Electrophoretogram of bar gene in some transgenic plants by PCR detection
2.3.3 转基因植株的抗稻瘟病鉴定 以非转基因水稻植株和易感品种蒙古稻植株作为对照,在温室对经PCR检测的98株阳性T1代转基因水稻植株进行苗期稻瘟病菌喷雾接种鉴定。部分植株的抗稻瘟病鉴定结果如图6所示,易感对照蒙古稻发病情况比较严重,逐渐萎蔫枯死。与非转基因植株对照相比,转基因植株出现病斑的时间较晚,病斑的扩展速度很慢,病斑比较小,能保持正常生长,说明转SFL基因的植株抗稻瘟病能力较非转基因植株明显提高。经苗期喷雾鉴定,最终筛选出稻瘟病抗性较强的转基因材料25份。
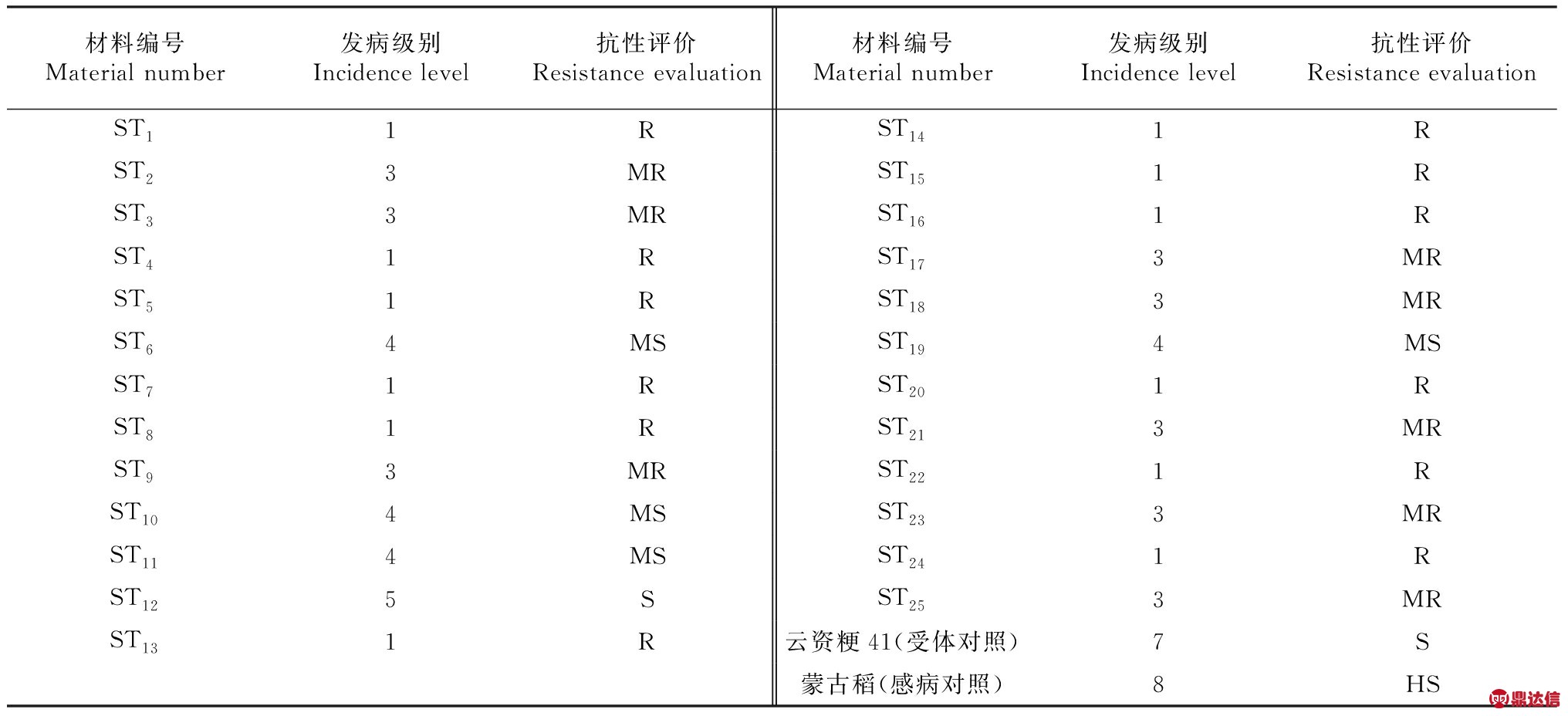
用当地稻瘟病高发田块中采集的感病株对种植于隔离基地大田间的T2代材料进行稻瘟病诱发鉴定,结果如表1所示,根据抗感情况最终筛选出具有较稳定抗稻瘟病能力的转SFL基因水稻新材料12份。

CK1:感病蒙古稻;CK2:非转基因对照‘云资粳41号’;1~5:转基因植株
CK1: Susceptible Mongolian rice; CK2: Non-transgenic control ‘Yunzijing 41’; 1-5: Transgenic plants
图6 部分转基因植株的抗稻瘟病鉴定
Fig.6 Identification of resistance to rice blast in some transgenic plants
表1 转SFL基因植株稻瘟病抗性大田诱发鉴定结果
Table 1 Identification of transgenic plants’ resistance to rice blast in the field induced
3 讨 论
真空渗透法是一种在植株原位真空渗入条件下所进行的农杆菌介导的遗传转化方法。目前该方法在拟南芥、油菜、芥菜、烟草、萝卜、猕猴桃、豆类、棉花等多种植物上已成功应用。在目前的真空渗透法有关研究报道中,应用多为拟南芥、芥菜、白菜等小型植物,且转化率普遍偏低,真正获得的有应用价值的转基因植物较少。这可能与现有真空容器容量较小以及真空渗透转化过程时因现有容器容量空间有限,多采用将受体植株挖出,将其直接倒放于容器中进行转化,转化完成后又移栽定植的转化操作方法有关[16-17,20-21,24-26],这种操作方式一方面并不是真正的原位转化,另一方面明显对转化后植株的生长状态、健壮程度和结实率有影响。此外,因真空容器中无固定部件很容易出现花序脱落或侧枝被压断,进而造成部分种子丢失,最终收获的转化子少。尽管根据该方法的原理和技术特点,该方法更倾向适用于个体较小、基因型依赖严重、组培困难的作物,但其具有操作简便快速、无遗传变异、转基因后代遗传一致性好、转化效率较高等独特优势是其它转基因方法所不可比拟的,即便对组培较容易的水稻等个体较大作物也值得尝试和探索。
本研究应用自主研制的水稻真空渗透转化装置,快速实现了外源SFL基因向受体水稻的原位转化。收获的T0代转化种子,经抗性筛选、检测以及鉴定后成功获得了一批具有抗稻瘟病能力的转基因植株。真空渗透法是在水稻上的初步尝试,但证实了该方法的可行性和实用性。真空时间、真空强度、渗透培养基、菌液浓度、转化时期等各种转化条件的优化及转基因后代材料的遗传稳定性等方面还有待进一步研究,以期真正建立起稳定高效的水稻真空渗透转化技术体系,为水稻及其它作物的基因转化提供技术参考。
4 结 论
真空渗透法应用于水稻的转化研究尚属首次应用,直接对开花前的活体水稻进行短暂抽真空处理,快速将苦参凝集素蛋白基因(SFL)成功转入水稻,并获得具有抗稻瘟病能力的转基因植株。这为水稻及其它作物的基因转化提供了另一重要途径,为品种的遗传改良和基因功能研究提供了强有力的技术保障。



