摘 要:密封垫片是现代工业生产设备中的一种重要基础元件,广泛用于管道和设备等可拆连接中。其中石墨垫片中的有害元素如硫和氯有可能对密封面造成腐蚀危害,尤其是可溶性氯离子对不锈钢密封件腐蚀更为严重。本文提出了离子选择电极测定石墨垫片与填料中可溶性氯离子含量的方法 对电极检测性能及干扰离子的消除等进行了一系列的测定与讨论。
关键词:垫片;氯离子;检测方法
垫片和填料密封在现代工业中占有很重要的地位,密封失效造成的跑、冒、滴、漏等,严重地影响生产的连续性,密封的好坏直接关系到生产安全,然而国内外通常使用的石墨垫片与填料在生产加工过程中或原料中含有一些可溶性的氯化物,在密封过程中这些可溶性氯化物游离出的氯离子使密封面、泵轴和阀杆引起腐蚀,导致泄漏率增大,进而破坏密封件的密封性能,甚至使密封失效,危及人身安全及设备的正常运行。目前国内只有对柔性石墨板氯含量的测定,使用JB/T 6622-93[1](燃烧-硫氰酸汞分光光度法测定),对其它材质的垫片测定还没有相应的方法,对填料中的可溶性氯离子含量的测定也没有相关报道。而燃烧—硫氰酸汞分光光度法测定柔性石墨板氯含量,此法测出的氯含量与可溶性的氯离子含量有偏差,所用到的设备要求较高耗能大,而GB4622.3-1993[2]提到的不锈钢法兰连接的缠绕式垫片的氯离子检测是用汞盐滴定法测定,由于试剂硝酸汞有毒.容易给环境造成污染,已经被废除,还没新的标准来代替。针对于目前国内还没有一个统一的标准来测定垫片中的可溶性氯离子含量,寻找出一种较为合理快速有效的检测方法显得十分必要。本文通过对垫片与填料的游离氯离子溶出做了试验研究,建立了离子选择法[3]快速检测垫片与填料中的游离氯离子。
1 实验原理及过程
1.1 实验仪器
pHS-3C 型酸度计,上海雷磁仪器厂;电磁搅拌器,上海雷磁仪器厂;pCl-1 型氯离子选择电极,上海精密科学仪器有限公司;217 型双液接饱和甘汞电极,上海精密科学仪器有限公司。
1.2 主要试剂与样品
NaCl(分析纯),天津化学试剂公司;KNO3(分析纯),天津化学试剂公司;NaOH(分析纯),北京化工试剂公司;其他试剂均为分析纯。石墨垫片5 份(1#、2#、3#、4#、5#)。
2 实验方法
2.1 氯离子标准样品的配制
准确称取分析纯KCl 37.2740 g(经105 ℃恒重),加去离子水溶解后转入500 mL 容量瓶定容,配置成不同浓度的一系列KCl 标准溶液。分别量取一定量的标准溶液于50 mL 的容量瓶中,加入5 mL 的1 mol/L 的KNO3 溶液,加入10 mL 的3%H2O2,由HNO3 (1∶20)调节溶液pH 值为3,加去离子水至刻度线。配置成氯离子浓度分别为1.0×10-1 mol/L、5.0×10-2 mol/L、1.0×10-2 mol/L、5.0×10-3 mol/L、1.0×10-3 mol/L、5.0×10-4 mol/L、1.0×10-4 mol/L、5.0×10-5 mol/L的标准溶液。
2.2 垫片试样的可溶性氯离子溶出和试液的配制
用剪刀剪取4 cm2 的垫片若干块,把剪好的垫片放在烘箱中100 ℃的条件下保持1 ~2 h。称取干燥过的垫片15.00 g,精确到0.01 g。把称好的垫片放在烧瓶中,加一定量的NaOH,用去离子水稀释成50 mL。把烧瓶放在水浴中,烧瓶上口接上冷凝管回流,在一定温度下蒸煮一定的时间。取出烧瓶过滤,取滤液。
2.3 Cl-的测定
用移液管准确的移取V mL 样品溶液,置于50 mL 的容量瓶中,加入5 mL KNO3(1 mol/L),加入1 mL 的30%H2O2,用(1∶20)的HNO3 溶液调节pH 值为3,最后用去离子水稀释至刻度线。然后把容量瓶中的溶液转移到烧杯中,置于加热套上加热至烧杯中液体沸腾,直至沸腾3 ~4 min,停止加热,冷却至室温,转移回容量瓶中,用去离子水稀释到刻度线。摇匀转回烧杯中,把烧杯置于磁力搅拌器以以一定的速度搅拌。在烧杯中插入氯离子选择电极和参比电极,等酸度计电位读数在一分钟内变化浮动不超过1 mV,记下电位值E。
由酸度计的电位值E 的测定,代入工作曲线图回归方程,计算出相对应的Cl-浓度C。
垫片中氯离子的含量(μg/g)按下式计算:
式中:C——在工作曲线查得的浓度,mol/L
V——从被测样品溶液中移取的体积,mL
V'——样品溶液的总体积,mL
m——剪取试样垫片的质量,g
3 结果与讨论
3.1 工作曲线的绘制及其线性检查
表1 工作曲线电位值的测定(KNO3 mol/L)
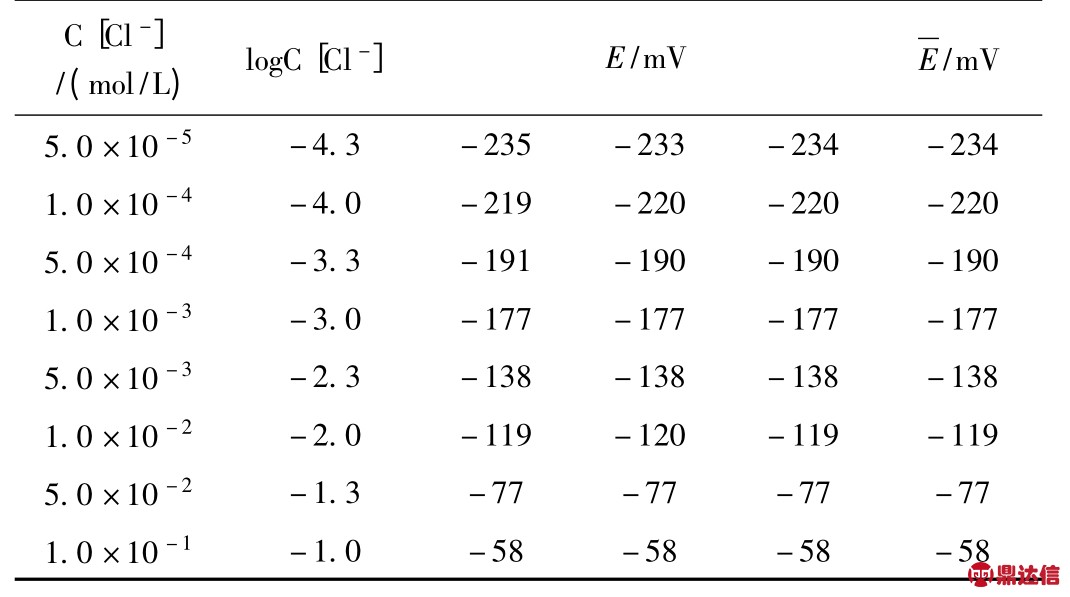
分别准确量取0.0010 mol/L 标准氯液2.50 mL,5.00 mL及0.1000 mol/L 标准氯溶液0.25 mL,0.50 mL,2.50 mL,5.00 mL 分别置6 个50 mL 容量瓶中,加入5 mL 的1 mol/L 的KNO3 溶液,加入10 mL 的3%的H2O2,再由HNO3 (1∶20)调节溶液pH 值为3,最后加入去离子水至刻度线。在磁力搅拌下,以氯离子选择电极为指示电极,双液接甘汞电极为参比电极,用PHS-3C 型酸度计由稀至浓分别测定平衡电位值,以电位毫伏对logC[Cl-]绘制工作曲线。结果见表1。
由表1 得出回归方程:Y=-10.20923+53.36444X,相关系数R=0.99705,此工作曲线表明仪器、电极以及选用的TISAB 体系良好。
3.2 实验条件的选择
3.2.1 TISAB 的选择
由于样品溶液中除了含氯离子和有机氯化物外还含有S2-、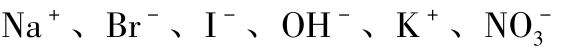 等离子。因此必须选择总离子强度调节剂以保持被测样液及标准系列pH 值的相对稳定以及离子强度的基本一致。本文选择硝酸钾试剂分别以四种不同的KNO3 浓度0.01 mol/L、0.1 mol/L、0.5 mol/L、1 mol/L,按实验步骤绘制各自的工作曲线图。
等离子。因此必须选择总离子强度调节剂以保持被测样液及标准系列pH 值的相对稳定以及离子强度的基本一致。本文选择硝酸钾试剂分别以四种不同的KNO3 浓度0.01 mol/L、0.1 mol/L、0.5 mol/L、1 mol/L,按实验步骤绘制各自的工作曲线图。
通过上述的四个图表可看出不同KNO3 浓度绘制的工作曲线也有区别,对其结果稳定性进行比较,其结果见表2。
表2 KNO3 浓度对电极稳定性影响

由表2 结果可见,使标准系列中含有0.1 mol/L KNO3 作为总离子强度调节剂,对电极的稳定性最佳。
3.2.2 酸度pH 值的影响
每种离子选择电极都有其适用的pH 范围,这一问题的实质就是指H+及OH-对使用电极测量的影响。因此分别测定不同pH 值下的1.0×10-4 mol/L 的氯离子标准溶液的电位值,比较结果控制pH 在2 ~4 内,电极的稳定性最好。
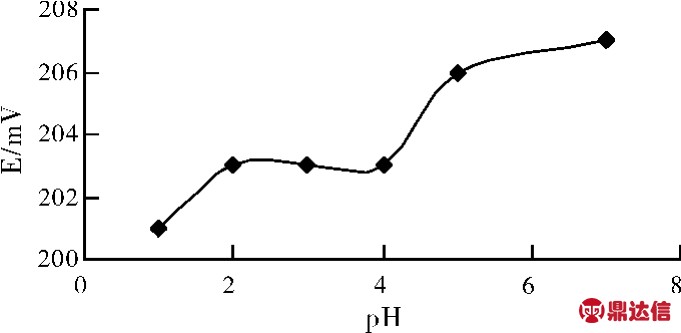
图1 酸度pH 值的影响
3.2.3 干扰离子的消除
在石墨垫片溶出液中,主要存在的干扰离子是S2-,当向标准样品中加入S2-时发现电位值明显变化,加入10 mL H2O2(3%)煮沸3 min 后,测定电位,观察到电位复原。干扰消除效果见表3。
表3 消除S2-干扰试验

3.3 垫片试样的测定
表4 垫片中游离Cl-测定结果
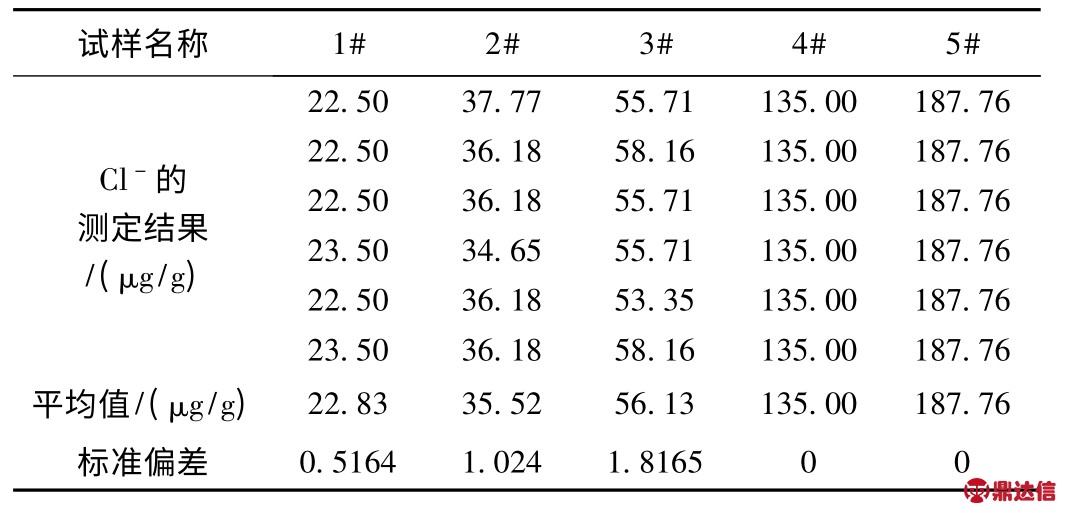
分别取不同厂家生产的石墨垫片用离子选择电极法测定各自氯含量结果见表4。
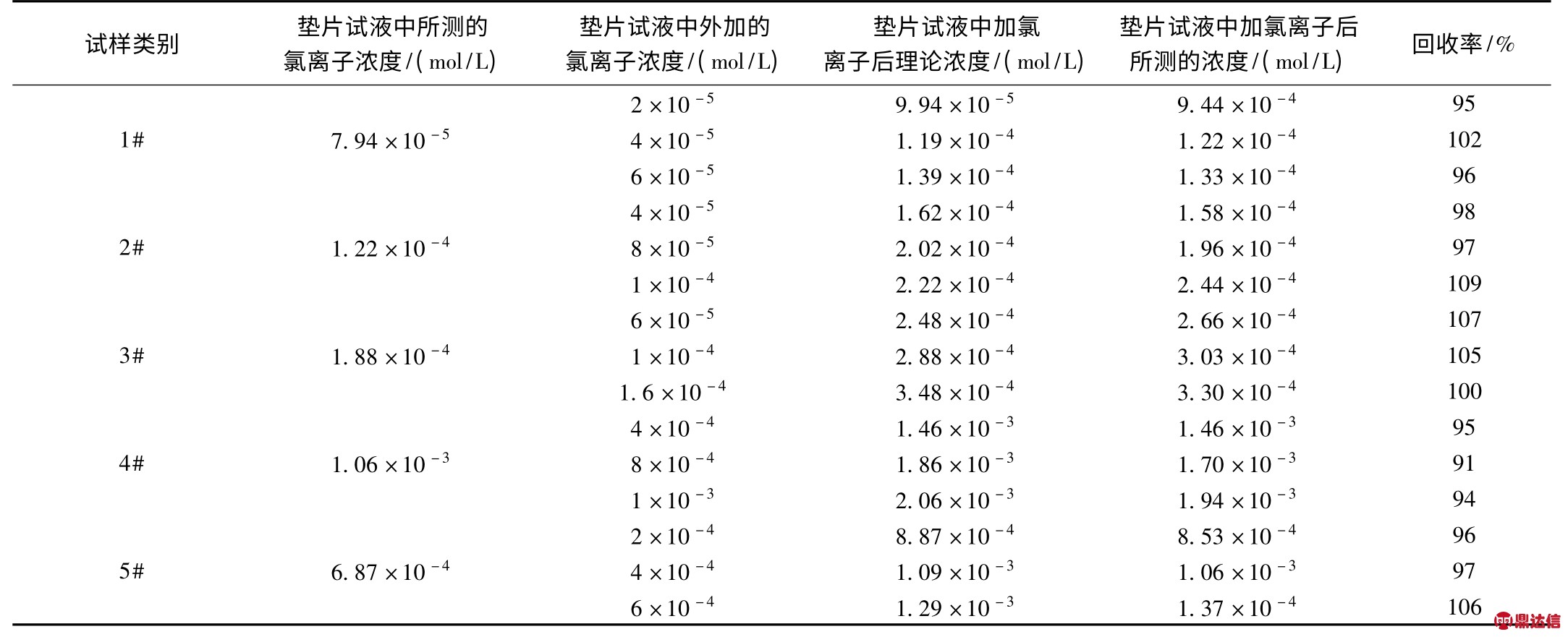
3.4 方法的回收率试验
由于收集不到含Cl-的垫片标准样,为了验证试验方案的准确性,进行了加Cl-回收试验。选若干份垫片试样,先分别测定其Cl-含量,然后在垫片的溶出样中分别加入已知量的Cl-再行测定其总的Cl-含量,见表5。从表中可看以出,回收率试验在加Cl-量,情况理想,平均收率为99.2%,因此从回收试验看,测氯方案是可行的。
表5 加Cl-回收试验结果(加的Cl-浓度2×10-5 mol/L)
4 结 论
氯离子选择电极测定石墨垫片中氯元素含量的方法是可行的该方法简便、快速,又比较准确。



