摘要 以2-S-(4-氨基苯)-1,4,7,10 四氮杂环壬烷-1,4,7,10-四乙酸(P-NH2-Bn-DOTA,简称DOTA)和重金属铅为研究对象,研究杂环类双功能螯合剂在重金属人工抗原制备方面的效果。选取DOTA 为双功能螯合剂,采用戊二醛法将重金属铅离子分别与载体蛋白BSA 和OVA 偶联制备免疫原和包被原,经测定其结合比分别为13∶1 和9∶1。用合成的免疫原免疫制备兔多克隆抗体并建立间接竞争ELISA(ic-ELISA),结果显示,其ic-ELISA 线性回归方程为y=12.014lnx-13.249(R2 =0.9951),IC50 和IC20 分别为193.4 ng/mL 和15.9 ng/mL,具有较好的检测灵敏度。交叉反应试验显示,除了与镉交叉反应率达20.4%外,该抗体与其它重金属铁、铅和锌等的交叉反应率均小于6.4%,特异性较好。本研究成功制备、鉴定了重金属铅人工抗原并制备了兔多克隆抗体。灵敏度和特异性分析表明:用杂环类双功能螯合剂制备的重金属人工抗原的制备效果较好,为下一步开展该杂环类双功能螯合剂在重金属快速检测技术中的研究奠定基础。
关键词 杂环类双功能螯合剂;DOTA;重金属;人工抗原;抗体
随着社会经济发展以及工业化进程的推进,大量的重金属产物流入环境中,不断累积,对环境造成越来越严重的影响。重金属具有易富集,不易降解等特点,可在环境中长期存在,同时还可通过大气、水和食物链等途径进入人体并产生富集现象,最终导致对人类健康的危害风险越来越大[1-2]。当人体中累积的重金属量超过人体能够耐受的极限后,会产生严重的生殖和遗传毒性反应,长期作用下会导致强烈的致癌、致畸及致突变反应[3-5]。
为减少重金属对环境和人体的危害性,除了有效减少重金属的排放外,还需加强对重金属的检测,提高检测技术水平和检测能力,以保障重金属安全。目前,检测、分析重金属最广泛的手段有原子吸收光谱分析(AAS)[6-9]、电感耦合等离子发射光谱(ICP-AES)[10-13]、阳极溶出伏安法(ASV)[14-15]、色谱法[16-17] 和其它多种联用检测方法,然而这些分析技术所使用的仪器价格昂贵,样品前处理过程复杂,检测分析时间长,需要专业技术人员操作,难以实现在环境及市场等现场的快速检测,在实际应用中存在局限性。免疫分析技术是以抗原抗体特异性反应为基础建立的分析方法,该技术简便、易操作,人员技术要求不高,所用仪器设备价格低廉,分析灵敏度好,能在基层现场实现大容量样本的快速、高效检测,很好的弥补了传统分析技术的不足,而且国外早在20世纪80年代就开展了采用免疫学方法针对重金属离子的检测研究,随后国内也开展了相关研究工作,截止目前已研制出抗汞、铜、镉和铅等重金属离子的特异性抗体,建立并优化了相关的免疫检测方法[18-25]。
免疫分析方法的建立关键在于优质抗体的研制,而要制备特异性好,灵敏度佳的优质抗体,就需要制备理想的抗原,优质的抗原是获得优质抗体的前提和基础。通常重金属离子的结构非常简单,导致其不能直接作为抗原,而且不能采用传统与蛋白偶联的方法制备人工抗原,需要在重金属离子和载体蛋白之间增加一个中间载体,既能很好地固定重金属离子,又能与载体蛋白有效结合,因此需用特殊的双功能螯合剂,将重金属离子固定后连接到BSA 或者OVA 等常用载体蛋白上制备重金属人工抗原。
现有研究使用的双功能螯合剂主要有EDTA、DTPA 和ITCBE 等,这些螯合物在结构上表现为直链开环结构及其结构衍生物[26-29],双功能螯合剂一端先与重金属离子螯合成稳定的复合物后,另一端与载体蛋白通过戊二醛法制备并纯化获得免疫抗原和反应抗原。免疫抗原进行动物免疫后制备多克隆抗体,在此基础上进行抗原抗体反应和分析方法建立,以验证抗原和抗体制备效果。本研究选取闭环结构的2-S-(4-氨基苯)-1,4,7,10四氮杂环壬烷-1,4,7,10-四乙酸(DOTA)为双功能螯合剂,通过与铅离子反应制备螯合物,然后与载体蛋白偶联制备人工抗原,并在此基础上通过动物免疫等手段制备多克隆抗体血清,通过抗体纯化并测定抗体特性,评价DOTA 作为双功能螯合剂在重金属人工抗原制备中的效果,为今后开展重金属铅免疫分析技术及检测产品研发提供参考。
1 材料与方法
1.1 材料与试剂
铜离子、锌离子、镉离子、铅离子和铁离子标准溶液、硝酸铅、4-羟乙基哌嗪乙磺酸(HEPES)、吐温-20,上海晶纯试剂公司;牛血清白蛋白(BSA)、鸡卵清蛋白(OVA)、四甲基联苯胺(TMB)、HRP 标记羊抗兔酶标二抗,美国Sigma 公司;超滤离心管(Amicon Ultra-15,30 ku),美国密理博公司;2-S-(4-氨基苯)-1,4,7,10 四氮杂环壬烷-1,4,7,10-四乙酸 (DOTA),美国AREVA MED 公司;96 孔高吸附酶标板,广州洁特公司;BCA 试剂盒,江苏碧云天公司;其它常规化学试剂为市售分析纯级。
1.2 仪器与设备
紫外分光度计 (Nicolet Evolut 60s),美国Thermo 公司;万分之一分析天平(BSA124S-CW型),德国赛多利斯公司;自动洗板机(Aquamax 2000),美国MD 公司;离心机(Fresco 21),美国Thermo 公司;酶标仪(IMARK-680 型)、电泳仪(Mini-Protean 4 型),美国Bio-rad 公司;纯水仪(Q-POD,Element),美国密理博公司;移液器,德国Eppendorf 公司。
1.3 动物实验
动物实验内容在浙江中医药大学动物实验中心进行,包括动物饲养、免疫原的免疫,以及抗血清的采集等,后续抗血清纯化及免疫学检测分析均在本实验室进行。
1.4 试验方法
1.4.1 人工抗原的合成 免疫原Pb-DOTA-BSA的合成采用戊二醛法,合成路线原理见图1,合成路线参考郭建军等[30] 的方法,具体方案如下:
A 液(DOTA 螯合剂溶液):准确称取8.5 mg DOTA 倒入5 mL 的离心管中,再加入2 mL 0.01 mol/L,pH 7.4 的N-2-羟乙基哌嗪-N-2-乙磺酸(HEPES)溶液,漩涡振荡溶解;
B 液(7.5×10-2 mol/L 硝酸铅溶液):准确称取124.2 mg 硝酸铅放入15 mL 离心管中,加入5 mL超纯水,漩涡振荡溶解;
C 液:吸取上述配制好的B 液180 μL 逐滴加入到A 液中,在磁力搅拌下室温避光缓慢搅拌,反应3 h;
D 液:吸取20 mmol/L 的戊二醛670 μL,边搅拌边缓慢逐滴加入C 液中,之后继续室温避光缓慢搅拌,反应12~14 h;
称取20 mg BSA 于称量瓶中,在磁力搅拌下加入3 mL 0.01 mol/L,pH 7.4 的HEPES,室温下磁力搅拌充分溶解后,将上述制备的D 液逐滴缓慢加入,在室温条件下避光搅拌,反应24 h。反应完全后,用预处理过的8 ku 的透析袋透析3~5次,每次间隔2 h,再将透析后的溶液用预处理的30 ku 超滤管离心,8 000 r/min 离心10 min,沉淀用HEPES 溶液 (0.01 mol/L,pH 7.4)4 mL 复溶洗涤后再离心,重复3~5 次,最后1 次用5 mL 0.01 mol/L,pH 7.4 的HEPES 复溶后分装于1.5 mL 灭菌过的离心管中,并保存于-20 ℃冰箱中备用。将BSA 替换为OVA 后,按照上述合成方法和步骤即可制备获得包被抗原Pb-DOTA-OVA。
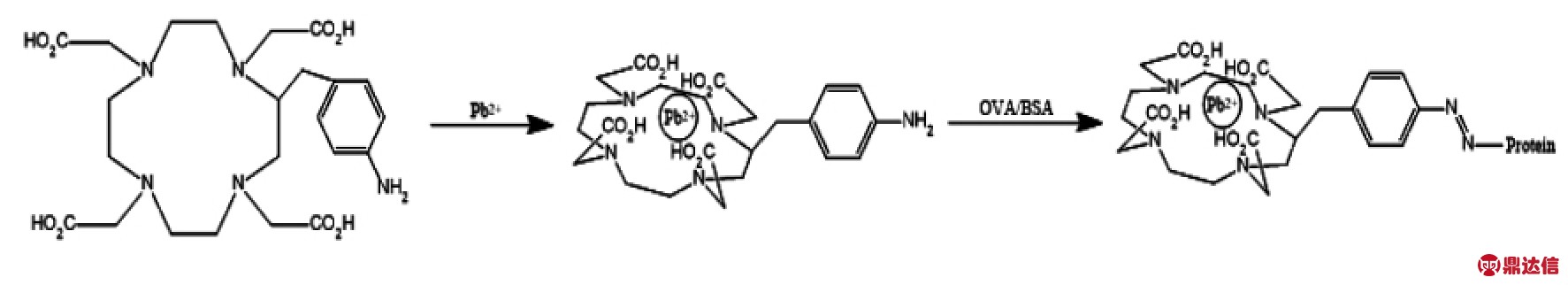
图1 重金属铅离子人工抗原合成路线
Fig.1 Synthetic route of artificial antigen of heavy metal lead ion
1.4.2 人工抗原的鉴定 半抗原螯合物和人工抗原合成效果的鉴定采用SDS-PAGE 电泳法结合紫外扫描法。SDS-PAGE 试验参数:浓缩胶和分离胶体积分数分别为5%和10%,样品上样量为每孔10 μL,浓缩胶和分离胶电压分别为60 V 和90 V,G250 染色1 h,摇床振荡脱色4 次,每次1 h,结果用凝胶成像仪拍照分析。紫外扫描试验步骤:配制适当浓度的Pb-DOTA,BSA,OVA,Pb-DOTABSA 和Pb-DOTA-OVA 等溶液,紫外扫描仪测定200~400 nm 波长范围内的吸光度,建立浓度和吸光度之间的相关性曲线,通过分析最大吸收波长变化情况,判断半抗原螯合物和人工抗原的合成效果。
1.4.3 人工抗原结合比的测定 通过测定人工抗原中铅离子的物质的量浓度和载体蛋白的物质的量浓度,比较计算后得出每分子载体蛋白中含有铅离子的数量,来计算人工抗原的结合比数据。其中,载体蛋白浓度采用BCA 蛋白浓度测定试剂盒测定后进行物质的量浓度转化,铅离子浓度采用ICP-MS 方法测定后进行物质的量浓度转化。
1.4.4 动物免疫 免疫方案按照郭建军等[30] 的方法。免疫动物为新西兰大白兔,体重2.5 kg 左右,数量3 只,免疫抗原为Pb-DOTA-BSA,免疫计量以载体蛋白的量为单位。具体免疫方案见表1。
从第2 次加强免疫后,定期采血检测,采用ELISA 法测定抗血清效价,从兔耳静脉采血1~2 mL,采集的血清在37 ℃培养30 min,用针头划拨血块后5 000 r/min 离心15 min,吸取离心上清10 μL 加入到2 mL 的封闭液中混匀,采用封闭液进行系列倍比稀释,稀释10 个梯度,稀释后的血清缓冲液采用间接ELISA 法测定。同时在动物免疫之前采集兔血清分离后作为阴性对照血清,测定梯度稀释的阳性血清与阴性血清OD450 的比值大于或等于2.1 时,所对应的稀释度定为抗血清效价。当2 次加强免疫之间测定的抗血清效价结果变化不明显时,说明免疫效果基本稳定,可以终止继续加强免疫。i-ELISA 检测试验步骤如下:
表1 Pb-DOTA-BSA 免疫方案
Table 1 The immune protocol of Pb-DOTA-BSA
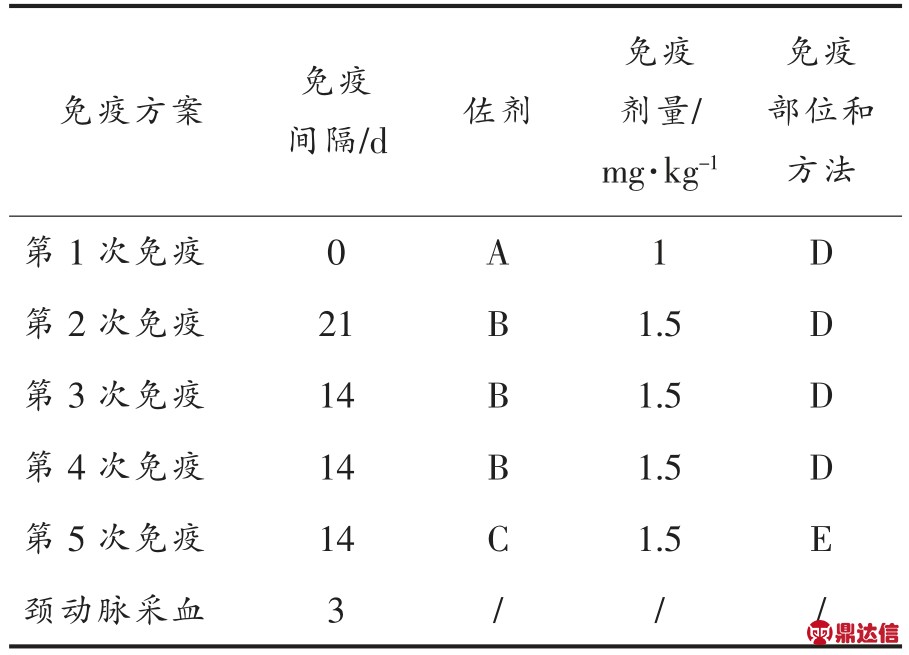
注:A 为完全佐剂;B 为不完全佐剂;C 为不使用佐剂;D 为背部皮下多点注射;E 为肌肉注射。
1)抗原包被 根据包被抗原浓度,用0.05 mol/L,pH 9.6 的CBS 均匀稀释至10 μg/mL,用8道移液器准确吸取100 μL 加入96 孔酶标板中,酶标板用封板膜封好后置于37 ℃恒温恒湿培养箱中反应2 h 后,用PBST 洗液洗板4 次,在吸水纸上拍干;
2)牛奶封闭 洗好的酶标板每孔加入2%脱脂牛奶溶液300 μL,封闭处理,置于37 ℃恒温恒湿培养箱中反应30 min 后,用PBST 洗液洗板4次,在吸水纸上拍干;
3)加抗血清 每孔加入100 μL 阴性血清对照和11 个梯度的抗血清样品,每梯度样品重复加4 个孔,封板膜封好后置于37 ℃恒温恒湿培养箱中反应1 h 后,用PBST 洗液洗板4 次,在吸水纸上拍干;
4)加酶标二抗 辣根过氧化物酶标记的羊抗兔酶标二抗用2%脱脂牛奶溶液稀释104 倍,酶标板每孔加100 μL 后用封板膜封好后置于37 ℃恒温恒湿培养箱中反应1 h,用PBST 洗液洗板4次,在吸水纸上拍干;
5)加底物显色 每孔加入100 μL TMB 显色液,封板膜封好后置于37 ℃恒温恒湿培养箱中反应20 min;
6)加硫酸终止反应检测 每孔加入2 mol/L硫酸50 μL 终止反应,用酶标仪读取OD450 值,分析计算。
1.4.5 多克隆抗体的制备与纯化 最后1 次免疫后第3 天,将新西兰大白兔固定在采血架上,用采血针从兔子颈动脉部位采集兔血清,采集的血清在4 ℃冰箱中放置2~4 h,将血块划碎后8 000 r/min 离心20 min,取上清采用辛酸-硫酸铵法[31] 纯化,具体步骤如下:
1)用60 mmol/L,pH 4.0 的醋酸盐缓冲液稀释抗血清,抗血清与缓冲液稀释体积比为1∶4,混合均匀后用0.1 mol/L NaOH 调节pH 值至4.5 后转入烧杯,置于磁力搅拌器上备用;
2)加入正辛酸去除脂类等杂质,加入量为每mL 血清加75 μL 正辛酸,在磁力搅拌下逐滴缓慢滴加,后继续搅拌反应30 min,转移至4 ℃冰箱静置2 h,反应液10 000 r/min 离心30 min 后,吸取上清,用定性滤纸过滤,去除杂质;
3)上清液与0.01 mol/L,pH 7.4 的PBS 按照体积比为1∶10 稀释配制,调节pH 值至7.4 后在4℃冰箱中预冷30 min;
4)按照每mL 混合液称取0.277 g 硫酸铵的比例准确称取硫酸铵,将预冷的缓冲液置于冰中,放置在磁力搅拌器上,边搅拌边少量多次加入硫酸铵,硫酸铵加完后继续搅拌30 min 后转移至4℃冰箱中静置3 h,用12 000 r/min 低温离心30 min 后吸去上清;
5)离心后沉淀用4 mL 0.01 mol/L,pH 7.4 的PBS 溶解后转入8 000 ku 透析袋中放入4 ℃冰箱中透析4~6 次,每次透析2~3 h,所用透析液为pH 7.4,0.01 mol/L 的PBS 缓冲液,透析完成后透析袋中的抗体进行冷冻干燥,制备成多抗冻干粉。
1.4.6 多克隆抗体效价的测定 为鉴定制备的多克隆抗体的特性,需要进行效价测定,测定方法和步骤参考1.4.4 节进行,将其中的抗血清替换为纯化的多克隆抗体即可。
1.4.7 标准曲线的建立 采用包被抗原和多抗以正交试验法确定最佳工作浓度,在此工作浓度下进行间接竞争ELISA 检测,具体试验步骤如下:
1)抗原包被 以Pb-DOTA-OVA 为包被抗原,以pH 9.6,0.05 mol/L CBS 为包被缓冲液,根据工作浓度配制包被抗原后,酶标板中每孔加入100 μL 后,置于37 ℃恒温恒湿培养箱中反应2 h后,用PBST 洗液洗板4 次,在吸水纸上拍干;
2)牛奶封闭 洗好的酶标板每孔加入2%脱脂牛奶溶液300 μL 封闭处理,置于37 ℃恒温恒湿培养箱中反应30 min 后,用PBST 洗液洗板4次,在吸水纸上拍干;
3)样品预处理 分别配制5 mmol/L 的DOTA 和不同浓度铅离子标样,在新的96 孔板中各加入100 μL 上述溶液,微量振荡混匀后用封板膜封板,置于37 ℃恒温恒湿培养箱中反应1 h;
4)加样检测 在封闭好的包被有抗原的酶标板中每孔加入预反应的样品50 μL 和2 倍工作浓度的多抗溶液50 μL,微量振荡混匀后用封板膜封板,置于37 ℃恒温恒湿培养箱中反应2 h,后用PBST 洗液洗板4 次,在吸水纸上拍干;
5)加酶标二抗 辣根过氧化物酶标记的羊抗兔酶标二抗用2%脱脂牛奶溶液稀释104 倍,酶标板每孔加100 μL 后用封板膜封好,置于37 ℃恒温恒湿培养箱中反应1 h,用PBST 洗液洗板4次,在吸水纸上拍干;
6)加底物显色 每孔加入100 μL TMB 显色液,封板膜封好后置于37 ℃恒温恒湿培养箱中反应20 min;
7)加硫酸终止反应检测 每孔加入2 mol/L硫酸50 μL 终止反应,用酶标仪读取OD450nm 值,分析计算。
1.4.8 抗体特异性测定 用ic-ELISA 法分别对锌、铁、镉和铜等离子抑制中浓度IC50 值检测,比较后计算得到交叉反应率。具体测定步骤参照1.4.7 节的方法,区别在于分别用待检测金属离子代替铅离子,根据ic-ELISA 法建立标准曲线计算IC50 值,然后再与铅离子的IC50 值比较计算交叉反应率。具体计算公式如下:
2 结果与分析
2.1 人工抗原的鉴定
人工抗原在200~400 nm 波长下做紫外扫描后建立扫描曲线,结果见图2。由图可知,包被抗原Pb-DOTA-OVA 和免疫抗原Pb-DOTA-BSA 的最大吸收波长均在260 nm 附近,而OVA 和BSA的最大吸收波长在278 nm 附近,结果表明,偶联物与载体蛋白的最大吸收峰所对应的波长值发生明显变化,初步说明载体蛋白上已有复合物偶联。
人工抗原和载体蛋白进行SDS-PAGE 电泳试验,结果见图3。由图3可知,免疫抗原Pb-DOTA-BSA 与BSA 蛋白相比,免疫抗原的最大吸收波长发生明显位移;同时包被抗原Pb-DOTAOVA 与OVA 蛋白相比,包被抗原的电泳条带也出现明显的滞后现象,说明人工抗原载体蛋白上连接了一定数量的重金属螯合物,分子质量变大,导致了电泳条带滞后和拖尾现象,再次证明偶联成功。
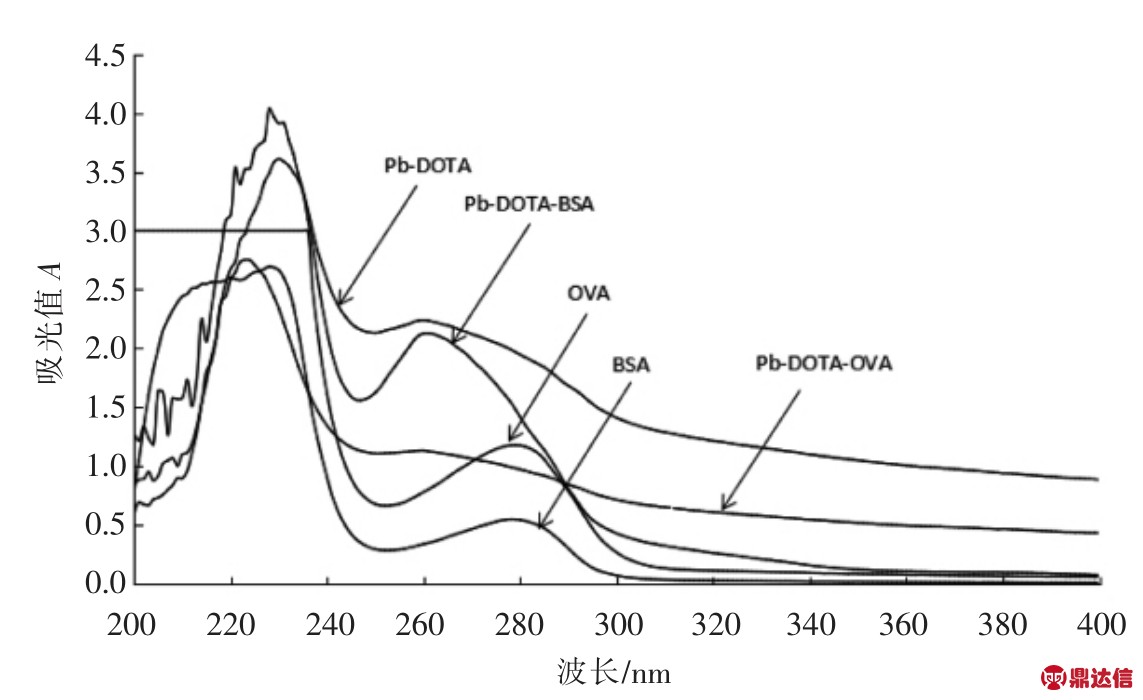
图2 铅离子人工抗原紫外扫描图
Fig.2 Ultraviolet scanning of artificial antigen of lead ion
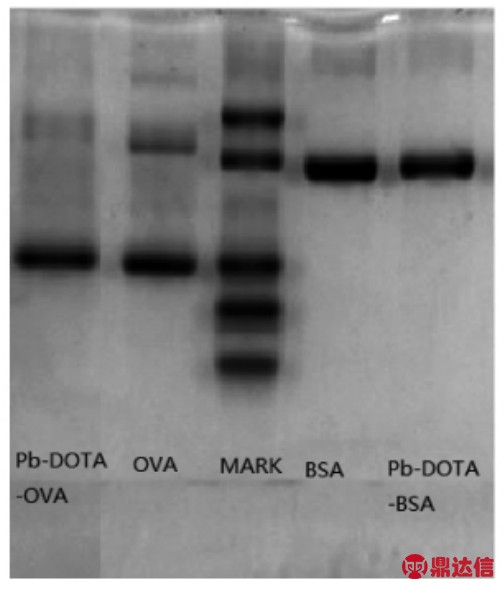
图3 铅离子人工抗原的SDS-PAGE 电泳图
Fig.3 The SDS-PAGE electrophoretogram of Pb ion artificial antigen
2.2 人工抗原结合比的测定
对制备的人工抗原分别进行蛋白质浓度和金属离子浓度的测定,通过比较计算结合比。BCA 蛋白浓度试剂盒测定蛋白质浓度,ICP-MS 法测定铅离子浓度,蛋白质浓度和铅离子浓度测定结果分别转化为物质的量浓度后,比较计算结合比分别为13∶1 和9∶1,说明1 个载体蛋白上分别连接了13 个和9 个铅离子,进一步验证已成功合成人工抗原。
2.3 抗体效价的测定
经i-ELISA 方法测定,3 只兔子免疫后制备的多抗效价分别为30 000∶1,42 000∶1 和45 000∶1,效价较高,说明制备的人工抗原能较好的引发兔子的免疫反应,制备的多抗效果佳,采用效价为45 000∶1 的多抗做后续试验。
2.4 标准曲线的建立
抗原抗体工作质量浓度为2.4 μg/mL 和3.2 μg/mL,按照ic-ELISA 试验步骤绘制竞争标准曲线并建立线性回归方程,具体曲线见图4。根据标准曲线建立相应的回归方程y=12.014ln(x)-13.249(R2 =0.9951),其中IC50 和IC20 值分别为193.4 ng/mL 和15.9 ng/mL。
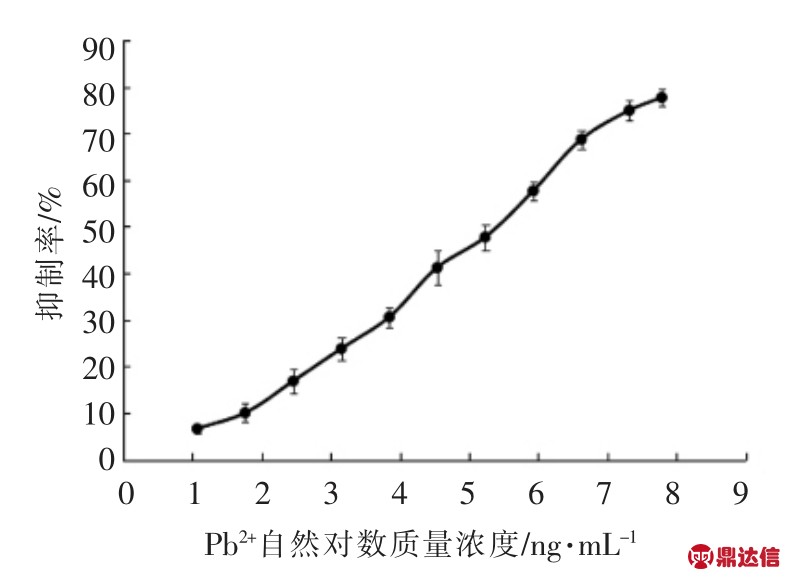
图4 ic-ELISA 标准曲线
Fig.4 Standard curve of indirect competitive ELISA
2.5 CR 值测定
为验证所制备多克隆抗体的特异性,对其它类似重金属离子采用ic-ELISA 测定IC50 值(检测结果见表2),从表2结果可知,镉离子的IC50 值较低,除根据其结果计算的CR 值达到20.4%以外,多克隆抗体与其它金属离子的CR 值均小于6.4%,制备的多克隆抗体特异性较理想,有较好的应用价值。
3 结论
以铅离子和双功能螯合剂2-S-(4-氨基苯)-1,4,7,10 四氮杂环壬烷-1,4,7,10-四乙酸(DOTA)为研究对象,制备了铅离子与DOTA 的螯合复合物,在此基础上采用戊二醛法制备、纯化和鉴定了包被抗原Pb-DOTA-OVA 和免疫抗原Pb-DOTA-BSA,通过动物免疫、抗血清制备、检测、纯化等一系列步骤获得抗铅离子的兔多抗。通过筛选工作浓度,优化建立了间接竞争ELISA 分析方法,绘制标准曲线并建立的回归方程为y=12.014ln (x)-13.249 (R2 =0.9951),其中IC50 和IC20 分别为193.4 ng/mL 和15.9 ng/mL,抗体特异性检测结果显示,除与镉离子的交叉反应率值较高外,多抗与其它金属离子交叉反应率值均小于6.4%,说明采用闭环结构双功能螯合剂DOTA 所制备的抗重金属铅多抗特异性好,灵敏度佳,以DOTA 为代表的闭环结构双功能螯合剂能用于金属离子人工抗原的制备,为下一步研制其它重金属离子优质高效的抗体,开展相关免疫分析方法研究提供技术依据。
表2 交叉反应率结果
Table 2 The results of cross reaction rate