摘 要:基于氨基功能化聚离子液体与Zn2+的金属-配位作用,在室温下组装形成了具有Lewis酸碱位点的聚离子液体基金属配合物PIL-Zn,并研究了其催化CO2与环氧氯丙烷生成氯丙烯碳酸酯的催化性能。通过酸碱位点的协同作用(Br-、Zn2+),PILZn可在0.1 MPa、75℃、24 h、无需外加溶剂及助催化剂的条件下高效催化转化CO2,环氧氯丙烷转化率和目标产物氯丙烯碳酸酯选择性分别为95%和99%,并且在循环使用5次后依旧保持良好的催化性能。PIL-Zn在催化转化CO2领域具有较好的应用潜力,为开发高性能催化剂材料提供了新的思路。
关键词:离子液体;金属配合物;CO2;环状碳酸酯;温和条件
CO2过量排放导致温室效应日益加剧,引发全球气候变暖等一系列生态问题[1],加大碳减排力度已成为当前全球面临的严峻挑战。同时,CO2作为无毒无害的C1资源,可转化为多种高附加值产品,如甲醇、环状碳酸酯、聚氨酯等[1,2]。因此,CO2高效资源化利用是实现CO2减排的有效途径之一。其中,CO2与环氧化合物发生环加成反应制备环状碳酸酯,因反应原子利用率100%、产品应用范围广等优势,被认为是CO2资源化利用最具发展前景的方向之一[3-5]。然而,由于CO2具有热力学稳定性和动力学惰性,通常需要较为严苛的反应条件方能实现活化[6]。因此,设计高效催化剂促进CO2在温和条件下催化转化,具有重要意义。
目前,多种均相和非均相催化剂,如离子液体、分子筛、金属复合物、金属有机框架(MOFs)、共价有机骨架(COFs)等被广泛用于催化CO2与环氧化合物环加成反应[7-9]。然而,受到活性位点不足等限制,目前发展的催化剂大多仍需在较高温度和压力抑或助催化剂四丁基溴化铵协助下实现CO2与环氧化合物环加成反应[7],致使反应能耗和成本均较高。Lewis酸碱多功能催化剂近年来引起了人们的广泛关注,其多重活性位点的协同作用有利于提高材料的催化活性[10-12]。离子液体是由阴阳离子组成、在室温下呈现熔融状态的有机盐[13],因其具有高热稳定性、不易挥发、溶解性好、功能可调等优点可广泛用于CO2捕集及转化[14-17]。由于均相离子液体的高黏度、高溶解性,导致其难以回收利用,限制了其应用和发展空间。将离子液体聚合制备成聚离子液体后,既可保持离子液体活性又能够解决上述问题[18,19]。然而,由单一离子液体聚合形成的聚离子液体活性位点单一,依旧较难实现CO2在温和条件下的活化转化。
本论文将氨基功能化离子液体先进行聚合,再通过氨基与金属离子的配位作用进一步组装得到一种兼具酸碱双重位点的催化剂——聚离子液体基锌配合物(PIL-Zn),并评价其温和条件下催化转化CO2与环氧化合物的反应性能及反应机理。
1 实验部分
1.1 实验试剂
1-乙烯基咪唑(99%),2-溴乙胺氢溴酸盐(98%),环氧氯丙烷(99%),偶氮二异丁腈(AIBN,99%),购自北京百灵威科技有限公司;六水合硝酸锌(Zn(NO3)2·6H2O,98%)、乙腈、无水甲醇、无水乙醇,分析纯,购自国药集团化学试剂有限公司;CO2(99.99%),购自太原钢铁公司。
1.2 催化剂的制备
1.2.1 氨基离子液体的合成
1-乙烯基-3-乙胺基咪唑溴盐·溴化氢制备[11]过程如图1所示:称取1-乙烯基咪唑11.29 g,2-溴乙胺氢溴酸盐20.40 g,50 mL乙腈,加入到100 mL圆底烧瓶中,N2保护下搅拌并75℃回流24 h。反应结束后冷却至室温,离心分离得白色固体产物,经无水乙醇洗涤三次、50℃真空干燥24 h即得氨基离子液体AVIMBr·HBr。AVIMBr·HBr的H谱 核 磁 数 据 为:1H NMR(400 MHz,DMSO):δ 9.68(s,1H),8.31(s,1H),8.01(s,1H),7.39(q,1H),6.01(s,1H),5.45(s,1H),4.54(m,2H),3.44(m,2H)。
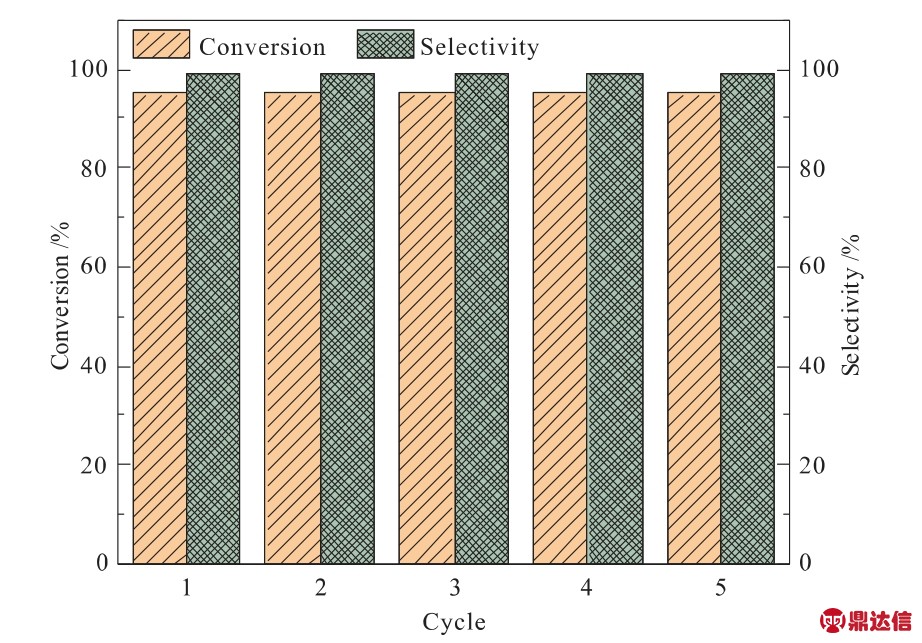
图1 氨基离子液体AVIMBr·HBr的合成路线
Fig.1 Synthetic route of amino ionic liquid AVIMBr·HBr
1.2.2 聚氨基离子液体(PIL)的合成
称取3.00 g AVIMBr·HBr、0.09 g AIBN(AVIMBr·HBr单体质量的3%)溶于30 mL无水甲醇中,N2保护下60℃回流24 h,得到黄色溶液1(P[AVIMBr·HBr]);向溶液中加入0.04 g NaOH,搅拌1 h,得到黄色溶液2(P[AVIMBr]);将黄色溶液2旋蒸除溶剂后50℃真空干燥12 h即得到聚氨基离子液体PIL。
1.2.3 聚氨基离子液体基锌配合物(PIL-Zn)的合成
称取0.74 g Zn(NO3)2·6H2O加入到上述黄色溶液2中,搅拌24 h后离心分离得到淡黄色沉淀,经无水甲醇洗涤三次后60℃真空干燥12 h即得PIL-Zn。
1.3 催化剂的表征
红外光谱(FT-IR)采用Bruker Vertex 70型红外光谱仪进行测试,样品与KBr按照质量比1:100混合后进行压片,扫描范围为400~4000 cm-1。使用Thermal VG公司ESCALAB 250型号的仪器对产物进行X射线光电子能谱(XPS)定性分析,采用Avantage软件对XPS谱图进行碳校正(校正峰为284.8 eV),并进行分峰处理。采用德国ZEISS Gemini SEM 300扫描电子显微镜观察样品的形貌特征。样品的比表面积和孔结构采用北京精微高博科学技术有限公司的JW-BK200系列比表面积及孔径分析仪进行测试,样品在测试前需要在100℃的真空状态下处理4 h,然后在-77 K的液氮条件下进行测定;其中比表面积采用BET方程进行计算,孔分布分析采用BJH法。热稳定性(TG)采用耐驰公司STA449F3同步热分析仪进行分析,测试气氛为N2,测试温度范围为30~800℃,升温速度为10℃/min。利用400 MHZ Bruker Advance核磁谱仪对催化产物进行分析,CDCl3做溶剂,采用5 mm BBO探头,共振频率为400 MHz,测定温度25℃。
1.4 催化性能评价
以转化率、选择性、循环稳定性为指标,对催化剂性能进行评价。转化率(X,%)、选择性(S,%)分别按式(1)、式(2)计算:
式中,C0和Ct分别表示环氧氯丙烷在0和t时的浓度,mol/L;Ccarbonate表示在相应时间内形成的氯丙烯碳酸酯的浓度,mol/L。
催化CO2和环氧氯丙烷的环加成反应如式(3)所示。将0.925 g环氧氯丙烷、0.125 g催化剂加入到25 mL圆底烧瓶中,并在烧瓶上方插入带有气球的三通阀。密封后抽真空,先向瓶内充适量的CO2,再抽真空,重复3次除去瓶中空气后充入CO2。将催化装置(图2)放到油浴锅中并升温至反应温度进行反应,磁力搅拌24 h,反应结束后冷却至室温,将未反应的CO2放出,进行物料衡算,离心分离后上清液进行核磁分析,沉淀用无水甲醇洗涤3次,60℃真空干燥8 h后回收。产物氯丙烯碳酸酯的核磁数据如下:1H NMR(400 MHz,CDCl3):δ 5.05(m,1H),4.65(dd,1H),4.43(dd,1H),3.89(m,2H)。

图2 催化反应装置
Fig.2 Catalytic apparatus
2 结果与讨论
2.1 催化剂的表征
2.1.1 FT-IR分析
样品的红外分析结果如图3所示。由图3可知,AVIMBr·HBr中乙烯基的C-H伸缩振动峰(962 cm-1)在PIL-Zn中消失,表明离子液体成功聚合[12]。在PILZn红外图谱中,1569 cm-1处的峰为咪唑环中C=C伸缩振动峰,1109 cm-1处代表的是离子液体链上N-H面外弯曲振动峰[20],这说明聚合后的离子液体成功组装到PIL-Zn中。
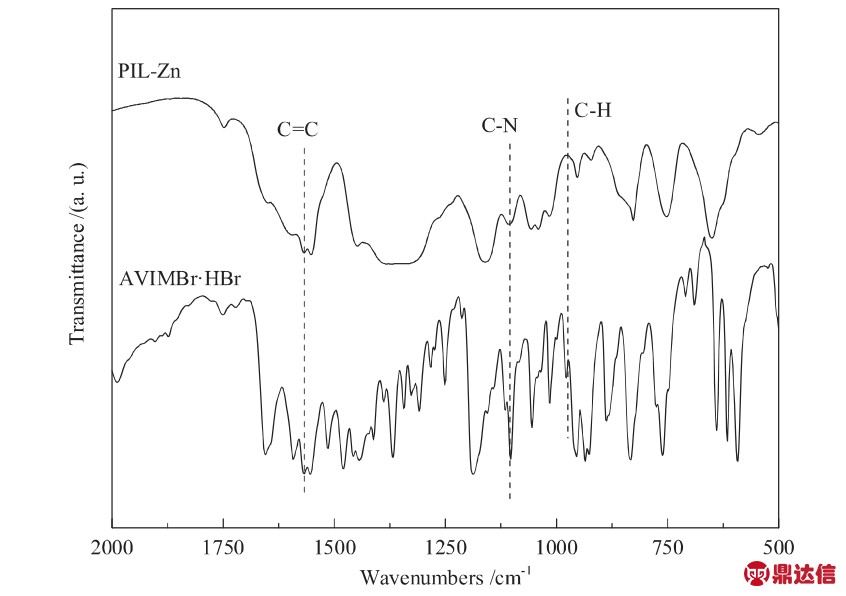
图3 PIL-Zn和AVIMBr·HBr的红外谱图
Fig.3 FT-IR spectra of PIL-Zn and AVIMBr·HBr
2.1.2 XPS分析
为验证-NH2与Zn2+发生配位,对PIL-Zn和AVIMBr·HBr进行了XPS测试,其N 1s谱测试结果如图4所示。在PIL-Zn和AVIMBr·HBr的XPS图谱中,398.2 eV和400.5 eV处均出现N 1s峰,分别属于离子液体中-NH2上的N和咪唑环上的N[21,22]。此外,在PIL-Zn中可以看到在398.68 eV处出现新的Zn-N峰,这是由于离子液体中的-NH2与Zn2+发生了配位作用[23]。
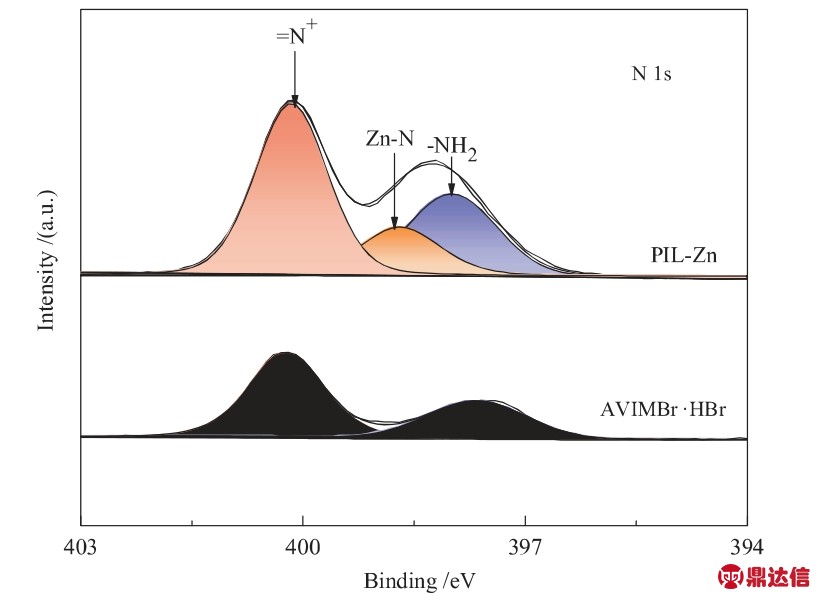
图4 PIL-Zn和AVIMBr·HBr的N 1s XPS谱图
Fig.4 N 1s XPS spectra of PIL-Zn and AVIMBr·HBr
2.1.3 SEM表征
对PIL-Zn进行SEM表征以观测样品的形貌特征,结果如图5所示。

图5 PIL-Zn的SEM照片Fig.5 SEM image of PIL-Zn
由图5可知,PIL-Zn是由颗粒堆积形成,具有不规则孔道,没有固定的形态,属于不定型聚合物。聚合物材料中的孔道结构有利于降低传质阻力,提高催化活性位点对环氧氯丙烷和CO2的活化速率。
2.1.4 孔结构分析
通过N2吸/脱附研究了PIL-Zn的孔结构,结果如图6所示,结构参数如表1所示。由测试结果可知,PIL-Zn的比表面积为5.0 m2/g,吸附等温线属于IUPCA中的Ⅲ型,具有H3型滞后环,孔径主要分布在3~8 nm之间,这表明PIL-Zn中具有介孔结构。介孔结构的存在,有利于充分的暴露催化活性位点,提高活性位点与环氧氯丙烷和CO2的接触面积,进而提高环氧氯丙烷的开环速率和CO2的活化速率。
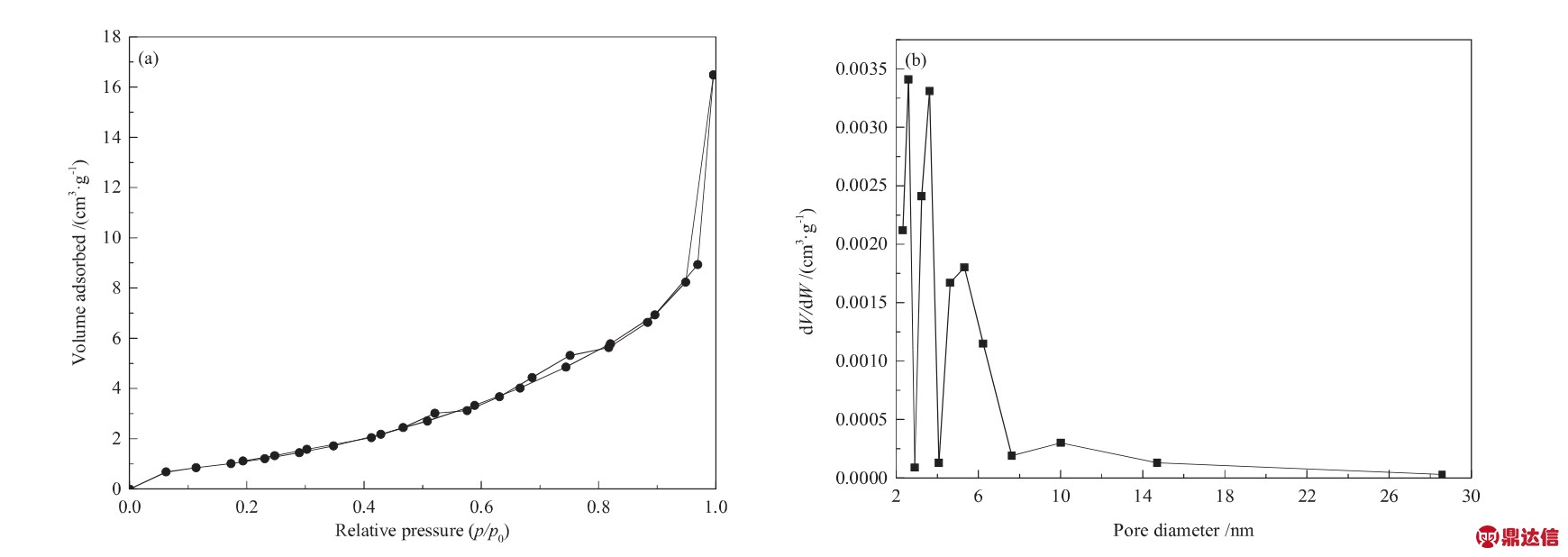
图6 PIL-Zn的N2吸/脱附(a)和孔径分布(b)
Fig.6(a)N2 adsorption/desorption isotherms and(b)the corresponding pore size distribution cures of PIL-Zn
表1 PIL-Zn的孔结构参数
Table 1 Textural parameters of PIL-Zn

2.1.5 热稳定性分析
对PIL-Zn的热稳定性进行分析,结果如图7所示。由图7可知,PIL-Zn在300℃以前基本没有重量损失,在300℃之后开始分解。这是由于高温使得配位键发生断裂,PIL-Zn的结构发生坍塌。PIL-Zn在300℃以前稳定性良好,说明其在低温下催化环氧氯丙烷与CO2环加成反应时,能够在催化过程中保持优异的结构稳定性。
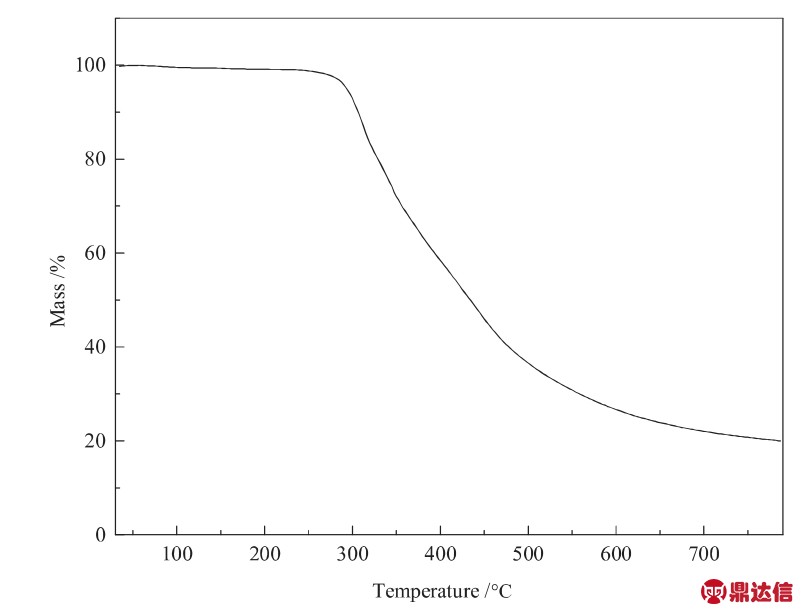
图7 PIL-Zn在N2氛围中的热重曲线
Fig.7 TG curve of PIL-Zn in N2 atmosphere
2.2 催化剂的催化性能评价
2.2.1 PIL与PIL-Zn催化加成性能比较
分别测试PIL、PIL-Zn对CO2和环氧氯丙烷环加成反应的催化性能,反应条件为:50℃、0.1 MPa、24 h,结果如图8所示。由图8可知,PIL-Zn作催化剂时环氧氯丙烷的转化率达到41%,而PIL只有11%。这是因为PIL-Zn中含有不饱和金属位点(Zn2+),其作为Lewis酸性位点能够与Br-产生协同作用,进而提高催化性能[23]。
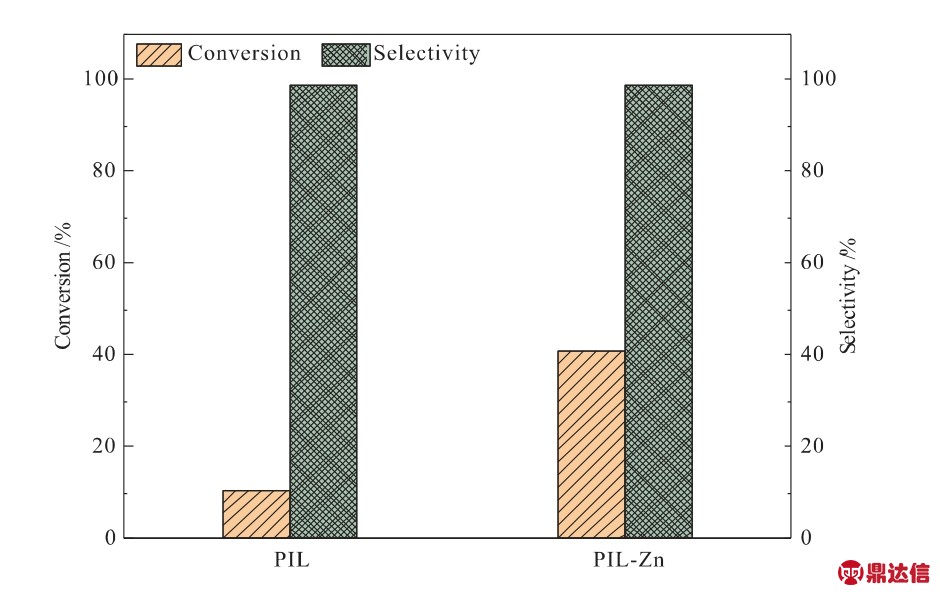
图8 PIL和PIL-Zn催化性能比较
Fig.8 Comparison of catalytic performance between PIL and PIL-Zn
2.2.2 反应条件对PIL-Zn催化加成性能的影响
为进一步提高PIL-Zn的催化性能,探究了反应时间和温度对其催化性能的影响,结果如图9、图10所示。由图9可知,在反应压力为0.1 MPa、反应时间为24 h时,反应温度对催化性能影响较大。随着温度升高,转化率快速上升,在反应温度达到75℃时,环氧氯丙烷的转化率高达95%。这是因为高温有利于激活CO2中的碳氧键,促进CO2的活化,从而提高环氧氯丙烷的转化率。继续升高温度至90℃,环氧氯丙烷的转化率未发生明显变化,说明PIL-Zn催化环氧氯丙烷的转化率已经趋于稳定。由图10可知,在反应压力0.1 MPa、反应温度75℃时,随着反应时间延长,转化率逐步提高,24 h后环氧氯丙烷的转化率达到95%,继续延长反应时间至36 h,环氧氯丙烷的转化率未出现明显变化,表明PIL-Zn在反应24 h后的催化性能达到最优。

图9 不同温度下PIL-Zn催化性能的变化
Fig.9 Change of catalytic performance of PIL-Zn at different temperatures

图10 不同反应时间下PIL-Zn催化性能的变化
Fig.10 Change of catalytic performance of PIL-Zn at different reaction time
2.2.3 PIL-Zn催化加成的循环稳定性
对PIL-Zn催化剂进行了循环稳定性测试,反应条件为:75℃、0.1 MPa、24 h,测试结果如图11所示。由图11可知,PIL-Zn在循环使用5次后,环氧氯丙烷的转化率没有下降(保持在95%)。由热稳定性分析可知,PIL-Zn在低温下具有优异的结构稳定性,在催化过程中,PIL-Zn中的活性位点(Br-、Zn2+)没有失活,因此催化剂在低温下具有良好的循环稳定性。

图11 PIL-Zn在0.1 MPa、75℃下的循环性能
Fig.11 Cycle performance of PIL-Zn at 0.1 MPa and 75℃
2.2.4 催化机理分析
基于文献[24,25]和上述催化表征及性能评价结果,进一步提出了PIL-Zn催化CO2环加成反应可能的机理,如图12所示。首先,PIL-Zn中的Zn2+作为Lewis酸性位点进攻环氧氯丙烷中的O原子,与此同时,Br-通过亲核反应攻击环氧氯丙烷上位阻较小的C原子,促使环氧氯丙烷开环。然后,CO2插入到开环的中间体中。最后,通过分子内闭环作用生成氯丙烯碳酸酯,同时催化剂再生。

图12 PIL-Zn的催化机理
Fig.12 Catalytic mechanism of PIL-Zn
3 结论
本文利用金属配位作用,通过聚氨基离子液体中的-NH2与Zn2+配位,制备了具有酸碱位点的聚离子液体基锌配合物PIL-Zn,用于温和条件下催化转化CO2。由于酸碱位点的协同作用,PIL-Zn相对于PIL催化性能明显提升。催化剂PIL-Zn在无溶剂、无助催化剂的温和条件(75℃、0.1 MPa、24 h)下,催化CO2与环氧氯丙烷的环加成反应,环氧氯丙烷转化率达到95%,目标产物氯丙烯碳酸酯选择性达到99%。该催化剂具有合成过程简单、催化性能好、循环稳定性高等优点,为高性能CO2转化催化剂的合成提供了新的思路。



