摘 要:针对分子氧环己烯催化环氧化反应转化率和环氧化选择性低、需要大量溶剂的加入等缺点,现以金属多氧酸盐 (POMs)和纳米金作为催化活性中心,采用混合甲醛还原法、水合肼&甲醛还原法、氢气&甲醛还原法等3种方式分别添加二元金属Co、Bi制备以ZSM-5分子筛作为载体的负载型金属多氧酸盐杂化催化剂,考察了二元金属种类及负载方法、POMs种类、反应条件等对催化剂在无溶剂条件下催化分子氧环己烯环氧化性能的影响。实验结果表明,以混合甲醛还原法负载二元金属Bi的催化剂性能比负载Co的催化剂更好,其中Bi较合适的表观负载量为0.5%;金属多氧酸盐选择PMo11和BMo11混合负载效果略优,总负载量w为6.67%,二者质量比为1:1,以此制备的催化剂1%Au-0.5%Bi/PMo11-BMo11/ZSM-5-m催化环氧化性能较佳,在反应压力0.5 MPa、反应温度80 ℃、环己烯2.0 g、3滴(约0.04 g)叔丁基过氧化氢(TBHP)、催化剂0.02 g的条件下反应18 h,环己烯的转化率可达39.3%,环氧环己烷的选择性可达到40.9%。
关键词:纳米金;金属多氧酸盐;催化剂;环己烯;环氧化
1 前 言
环己烯环氧化生产高附加值产品环氧环己烷是一个典型的烯烃环氧化探针反应。采用分子氧作为氧源,绿色环保、成本低廉及原子利用率高,是未来绿色氧化工艺的理想氧源之一[1-2]。但由于环己烯具有不饱和C═C和活泼的α-H,以及分子氧所具有的稳定性,导致以环己烯分子氧环氧化非常困难[3],且氧化产物较复杂,选择性不高[4-5]。目前,寻求一种高活性、高选择性的催化剂用于环己烯分子氧环氧化反应仍是巨大的挑战。
分子氧环己烯环氧化的催化剂根据其组成与结构的差异主要分为金属-有机结构类催化剂[6]、金属氧化物催化剂、无机分子筛类催化剂、金属多氧酸盐类催化剂[7]和负载型催化剂等5类[8-9]。其中,负载型催化剂具有制备简单、成本低廉、催化环氧化效果好等特点,并且这类催化剂在稳定性、机械强度、比表面积等方面均有优势,例如SONG等[10]制备了负载型催化剂PMo11Co/SBA-15,以乙腈作溶剂,异丁醛作共还原剂,在40 ℃及1 atm氧压下反应4 h可达81%的转化率和90%的环氧化选择性。目前已有多种高效催化活性中心如金属-有机框架结构[11]、金属多氧酸盐(POMs)[12-13]和纳米金[14-16]等用于环己烯环氧化反应,而包含这些催化活性中心的负载型催化剂可能会对分子氧在无溶剂无共还原剂的条件下催化环氧化环己烯研究产生更好的效果,值得借鉴并进一步深入研究。
本文制备负载型杂化催化剂用于催化环己烯环氧化的反应。以价格低廉的ZSM-5分子筛作为载体,采用浸渍还原法负载纳米金,并用3种不同方式负载Bi、Co二元金属进行掺杂,再以浸渍混合法[17]负载POMs制备负载型金属多氧酸盐杂化催化剂。然后,以分子氧作为氧源,加入少量叔丁基过氧化氢(TBHP)作为引发剂,考察催化环己烯环氧化的反应性能。
2 实验部分
2.1 化学试剂和原料
氧气(O2,99.5%),杭州今工特种气体有限公司;ZSM-5分子筛,上海欣年石化助剂有限公司;氯金酸(HAuCl4·4H2O,≥47.8%),上海麦克林生化科技有限公司;环己烯(C6H10,≥98%),国药集团化学试剂有限公司;磷酸氢二钠(Na2HPO4·7H2O,≥99%),国药集团化学试剂有限公司;钼酸钠(Na2MoO4·2H2O,≥99%),国药集团化学试剂有限公司;甲醛(CH2O,37%~40%),国药集团化学试剂有限公司;水合肼(N2H4·H2O,≥85%),国药集团化学试剂有限公司;钨酸钠(Na2WO4·2H2O,≥99%),国药集团化学试剂有限公司;叔丁基过氧化氢TBHP(C4H10O2,≥65%),国药集团化学试剂有限公司;硝酸钴(Co(NO3)2·6H2O,≥99%),国药集团化学试剂有限公司;硝酸铋(Bi(NO3)3·5H2O,≥99%),国药集团化学试剂有限公司;硼酸(H3BO3,≥99.5%),国药集团化学试剂有限公司。
2.2 催化剂制备
2.2.1 金属多氧酸盐POMs的制备
按照文献[18-21]的制备方法得到磷钼金属多氧酸盐PMo11和硼钨金属多氧酸盐BW11 (PW11制备时对应PMo11的制备将钼酸钠换成钨酸钠,BMo11制备时对应BW11的制备将钨酸钠换成钼酸钠。)
2.2.2 ZSM-5的改性
取ZSM-5分子筛(白色粉末),置入400 ℃的马弗炉,焙烧约4 h,得到经过焙烧的ZSM-5载体(黄色粉末),接着在浓度为0.4 mol×L-1的NaOH溶液75 mL中加入经过焙烧的ZSM-5载体1.0 g,并加热至70 ℃,搅拌1 h之后立刻取出置入冰浴中冷却阻止其继续进行反应,15 min之后抽滤,并用去离子水洗涤2~3次,在70 ℃烘干,得到ZSM-5-m (改性ZSM-5)[22]。
2.2.3 催化剂1%Au-1%M/ZSM-5-m的制备
对于双金属负载催化剂,采用3种方法分别进行负载,其中二元金属M选择Co、Bi两种。本文以含Co (含量1%)催化剂的制备过程为例,叙述如下。
混合甲醛还原法:称取0.15 g聚乙烯醇溶于15 mL水,加入浓度为20 g×L-1的四水氯金酸溶液0.53 mL以及1.23 mL浓度为20 g×L-1的硝酸钴溶液,在30 ℃下搅拌30 min,再加入0.5 g载体ZSM-5-m,继续搅拌30 min,之后加入尿素0.45 g作为pH调节剂,升温至80 ℃,搅拌5 h后,再加入30 mL甲醛溶液还原2 h,最后冷却10 min,抽滤并洗涤2~3次,置入90 ℃的烘箱干燥12 h,得到1%Au-1%Co/ZSM-5-m。
水合肼[23]&甲醛还原法:在25 mL去离子水中加入1.23 mL硝酸钴溶液(20 g×L-1),于60 ℃搅拌30 min,再加入0.5 g 的ZSM-5-m及1 mL浓度为1 mol×L-1的NaOH溶液调至碱性,继续搅拌30 min,加入3 mL水合肼还原2 h,抽滤洗涤2~3次,在90 ℃烘干得到催化中间体1%Co/ZSM-5-m。再以此中间体进行纳米金催化剂制备步骤[18],即可得到通过水合肼&甲醛还原法制备的1%Au-1%Co/ZSM-5-m催化剂。
氢气&甲醛还原法:在15 mL去离子水中加入0.5 g载体ZSM-5-m及1.23 mL硝酸钴溶液(20 g×L-1),在85~90 ℃下搅拌蒸发,待水蒸干后,在90 ℃下干燥3 h,将所得固体在700 ℃焙烧3 h,得到灰色固体,将该固体在管式炉中以氢气在500 ℃下还原2 h,得到1%Co/ZSM-5-m催化中间体。以此中间体再进行纳米金催化剂制备步骤,即可得到通过氢气&甲醛还原法制备的1%Au-1%Co/ZSM-5-m催化剂。
2.2.4 催化剂1%Au-1%M/PMo11/ZSM-5-m的制备
称取0.5 g 由2.2.3节制备的1%Au-1%M/ZSM-5-m双金属杂化负载催化剂,加入质量为0.033 g的PMo11 (负载量w=6.67%),并加入15 mL水,在50~60 ℃搅拌36 h (搅拌36 h之后水基本蒸干),置入90 ℃烘箱烘干12 h,即可得到催化剂1%Au-1%M/PMo11/ZSM-5-m[17] (M为二元金属Co或Bi)。
金属多氧酸盐PMo11可以替换为BMo11、PW11、BW11或者两两组合负载,总负载量为w=6.67%,其中两两组合负载两种POMs的质量比为1:1。其中催化剂1%Au-0.5%Bi/PMo11-BMo11/ZSM-5-m即选用BMo11和PMo11作金属多氧酸盐,Bi作为二元金属且负载量0.5%制备得到的。
2.3 催化剂表征
在X’Pert PRO型X射线衍射仪上进行催化剂的XRD分析,CuKα靶作为辐射源,扫描范围为2θ=10°~80°,催化剂研磨至300目以上。在型号为Hitachi S-3700N的钨灯丝扫描电子显微镜上进行催化剂EDS分析,最高加速电压30 kV,最高分辨率30 nm。在型号为SU-8010的扫描电子显微镜上进行催化剂SEM分析,加速电压0.1~30 kV;放大倍数20~80万倍,镀金后测试。在型号为HT-7700的透射电子显微镜上进行催化剂的TEM分析,0.144 nm晶格分辨率,0.33 nm点分辨率,加速电压为40~120 kV。采用铜网作为载物片,取少量样品加入无水乙醇中,离心分散5 min,以取样器吸取分散液滴于铜网上,待乙醇挥发后即可用于TEM分析测试。
2.4 催化剂活性评价
催化剂的活性评价在聚四氟乙烯(PTFE)内衬的不锈钢高压釜中进行。加入环己烯2.0 g,催化剂0.02 g,再加入3滴TBHP (约0.04 g,下同),在磁力搅拌下升温至目标温度,通入氧气开始计时。反应结束后,将反应混合物离心分离。分离的催化剂用丙酮洗涤多次回收利用,液相采用GC-1690进行气相色谱分析。色谱柱为SE-54型毛细管柱,规格为30 m×0.32 mm×0.5 μm,FID检测器,以正己烷作为内标。
3 结果与讨论
3.1 催化剂表征
图1是催化剂1%Au-0.5%Bi/PMo11- BMo11/ZSM-5-m及ZSM-5-m、PMo11、BMo11的XRD图谱。其中图谱d除了在2θ=38.2°出现一个较小的Au特征峰(111)以及在2θ=28.5°处有一个偏小的Bi特征峰(110)之外,其余与图谱c没有非常明显的差异,这可能由于Au、Bi的负载量过低或者Au、Bi分散度高且颗粒小导致无法观察或只能观察到较小的特征衍射峰。对于金属多氧酸盐而言(图谱a、b),由于其主要特征衍射峰和ZSM-5-m有所重叠,且其负载量也不大,因此在图谱d中也无较明显的显示。
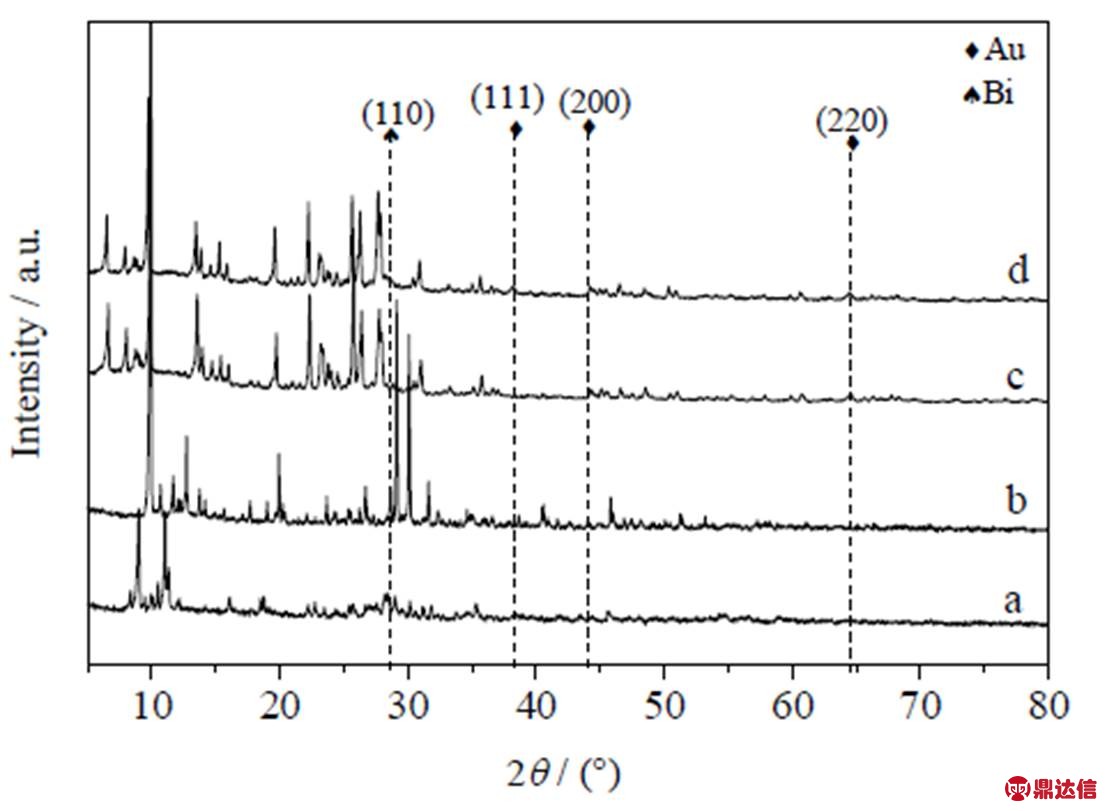
图1 催化剂1%Au-0.5%Bi/PMo11-BMo11/ZSM-5-m的XRD图
Fig.1 XRD patterns of catalyst 1%Au-0.5%Bi/PMo11-BMo11/ZSM-5-m
a. PMo11 b. BMo11 c. ZSM-5-m d. catalyst 1%Au-0.5%Bi/PMo11-BMo11/ZSM-5-m
图2和图3分别是载体ZSM-5改性前后、催化剂1%Au/PMo11/ZSM-5-m和负载型金属多氧酸盐杂化催化剂1%Au-0.5%Bi/PMo11-BMo11/ZSM-5-m的扫描电镜图。由图2可看到,ZSM-5改性前是形态较规整的条块状,而改性后则呈现片块状或层状,形态更薄,且表面出现褶皱不平整,更易于负载活性中心。由图3也可见,ZSM-5表面出现小碎粒,说明催化活性中心已负载在催化剂上,且除了孔道以外,在表面也有一部分活性中心被负载。负载前后,ZSM-5的结构没发生改变,说明该负载方法不会对分子筛产生破坏。

图2 ZSM-5及催化剂1%Au/PMo11/ZSM-5-m的扫描电镜图
Fig.2 SEM micrographs of ZSM-5 and catalyst1%Au/PMo11/ZSM-5-m
A. ZSM-5 B. ZSM-5-m C,D. 1%Au/PMo11/ZSM-5-m

图3 催化剂1%Au-0.5%Bi/PMo11- BMo11/ZSM-5-m的扫描电镜图
Fig.3 SEM micrographs of catalyst1%Au-0.5%Bi/PMo11-BMo11/ZSM-5-m
图4是POMs和催化剂1%Au-0.5%Bi/PMo11-BMo11/ZSM-5-m的EDS光谱图。以图A为例可以看到,PMo11含有O、Na、P和Mo元素,且P和Mo的原子比为12.43,与11相接近。由C可以看到,1%Au-0.5%Bi/PMo11-BMo11/ZSM-5-m催化剂中含有B、P、Mo、O、Bi、Au、Si、Al、Na、K元素,说明催化活性中心已经负载在ZSM-5上了。
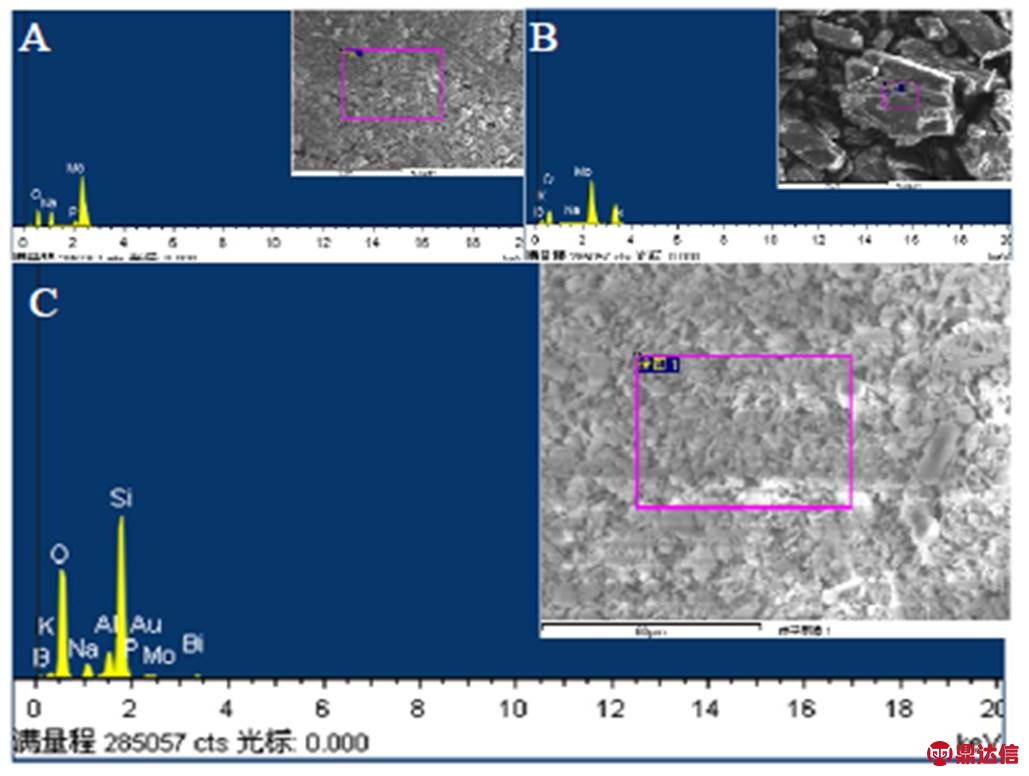
图4 催化剂1%Au-0.5%Bi/PMo11-BMo11/ZSM-5-m和POMs的EDS光谱
Fig.4 EDS spectra of POMs and catalyst 1%Au-0.5%Bi/PMo11-BMo11/ZSM-5-m
A. PMo11 B. BMo11 C. 1%Au-0.5%Bi/PMo11-BMo11/ZSM-5-m

图5 催化剂1%Au-0.5%Bi/PMo11- BMo11/ZSM-5-m的TEM图
Fig.5 TEM micrographs of catalyst1%Au-0.5%Bi/PMo11-BMo11/ZSM-5-m
图5是催化剂1%Au-0.5%Bi/PMo11-BMo11/ZSM-5-m的透射电镜图。由图可看到较多的深色点(为催化活性中心颗粒),这些颗粒根据大小形状分为两种,一种呈现球状或椭球状,分布均匀且尺寸约10~20 nm,猜测可能是Au或Bi游离颗粒;另一种颗粒尺寸较大,在40 nm以上,呈现多球结合的形态,猜测可能是金属多氧酸盐和Au或Bi颗粒发生结合产生的。根据TEM图也可知,金属多氧酸盐和纳米金等催化活性中心已成功负载于催化剂上。其中纳米金等小颗粒对反应物具有吸附催化活化作用,而Au与金属多氧酸盐结合的大颗粒具有优秀的催化环氧化效果。
3.2 环己烯环氧化催化性能
3.2.1 制备方法对催化性能的影响
采用1-混合甲醛还原法、2-水合肼&甲醛还原法和3-氢气&甲醛还原法分别负载二元金属Bi、Co和Au制备的催化剂1%Au-1%M (metal)/ Mo11/ZSM-5-m,分别用于环己烯分子氧催化环氧化,考察不同二元金属及制备方法对催化剂性能的影响,结果见表1。
表1 不同制备方法对催化剂催化环氧化环己烯性能的影响
Table1 Effects of load methods on the epoxidation of cyclohexene
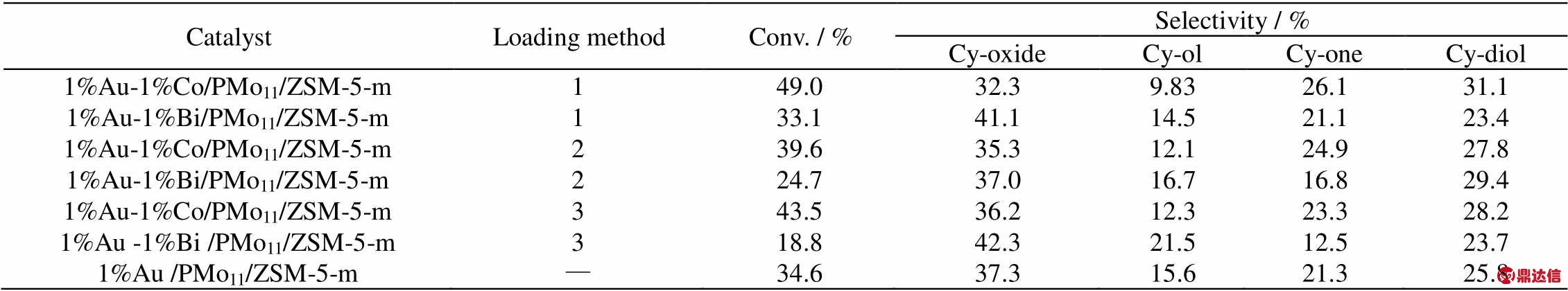
Loading method 1 is formaldehyde reduction method, 2 is hydrazine hydrate reduction method, 3 is hydrogen reduction method. Cy-oxide is cyclohexene oxide, Cy-ol is cyclohexenol, Cy-one is cyclohexenone, Cy-diol is cyclohexanediol, the same blew. Reaction conditions: catalyst 0.02 g, cyclohexene 2.0 g, TBHP 3 drops, pressure 0.8 MPa, temperature 80 ℃, action time 18 h.
由表1可以看到,无二元金属的催化剂实验结果为环己烯转化率34.6%,环氧环己烷选择性37.3%,环氧化收率为12.9%。当二元金属选用Bi时,催化剂催化环氧化选择性较优,但转化率不高;而二元金属选择Co时,催化环己烯氧化的转化率较高,但相对的选择性偏低。这说明二元辅助金属的添加能与Au产生协同催化效果,二元金属Bi对于环氧环己烷的生成有增益效果且对副反应有一定的抑制能力;而二元金属Co则可以促进环己烯和分子氧反应,明显提高转化率。
比较不同方式制备的各组催化效果可知,对于Co而言,三种方式制备的催化剂催化环氧化效果相似,均出现转化率明显提升而选择性下降的现象,其中以负载方法1和3的效果略优,方法1可达49.0%的环己烯转化率和32.3%的环氧化选择性;而对于Bi而言,可以看到,方法1制备的催化剂催化环氧化效果明显优于方法2和3,可达33.1%的环己烯转化率及41.1%的环氧化选择性。这说明并不是还原能力越强或越弱的还原剂对二元金属的还原负载越有利,对于不同的二元金属负载有各自对应合适的负载方式,对于Bi和Co本文选择使用方法1混合甲醛还原法进行负载制备。
3.2.2 二元金属负载量对催化性能的影响
采用混合甲醛还原法制备催化剂,在反应条件不变的情况下,考察二元金属Co、Bi的表观负载量对环己烯催化环氧化的影响,实验结果如图6和图7所示。

图6 Co表观负载量对催化剂催化环氧化效果的影响
Fig.6 Effects of Co loading contents on the epoxidation of cyclohexene Reaction conditions: catalyst 0.02 g, cyclohexene 2.0 g, TBHP 3 drops, reaction pressure 0.8 MPa, temperature 80 ℃, reaction time 18 h.
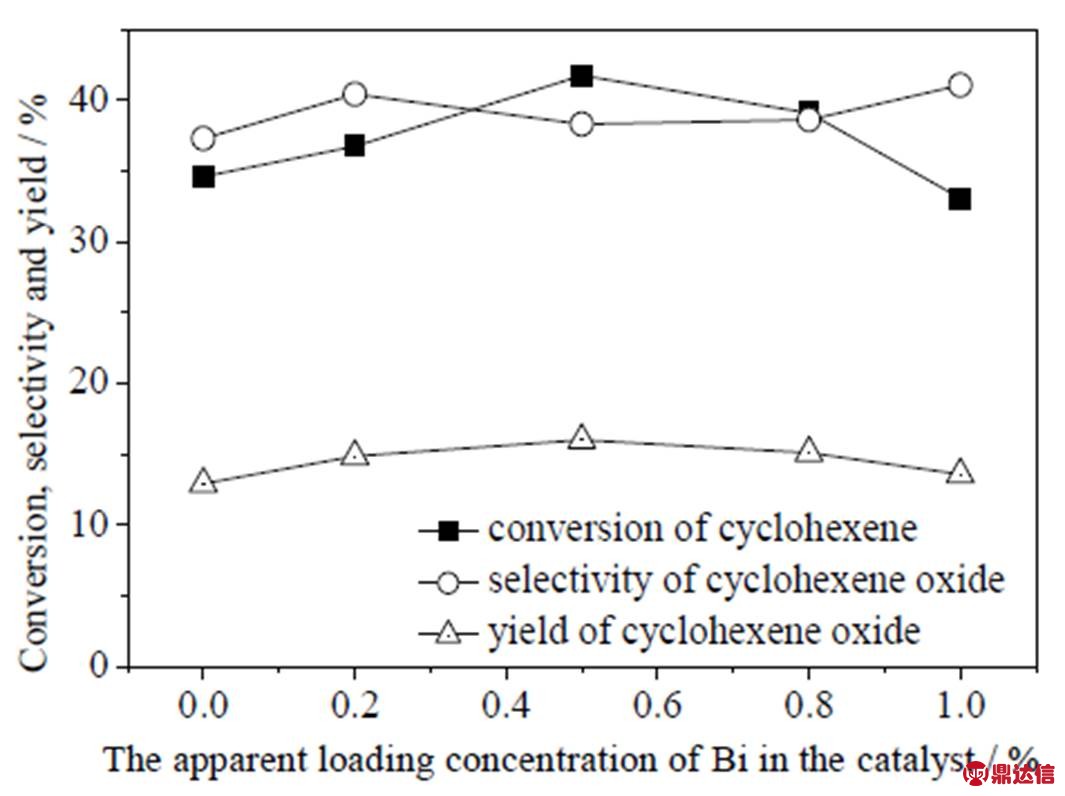
图7 Bi表观负载量对催化剂催化环氧化效果的影响
Fig.7 Effects of Bi loading contents on the epoxidation of cyclohexene Reaction conditions: catalyst 0.02 g, cyclohexene 2.0 g, TBHP 3 drops, reaction pressure 0.8 MPa, temperature 80 ℃, reaction time 18 h
分析图6可知,随着Co的负载量上升,环己烯的转化率也随之提高,但是环氧化选择性却随之下降,而环氧化收率呈现先增加后减小的变化趋势,在Co负载量0.5%时,催化环氧化效果相对较优,环己烯转化率43.4%,环氧环己烷的选择性为36.0%,这说明可能在Co表观负载量0.5%时,其与Au、PMo11的协同作用较强;根据图7的曲线变化趋势可知,随着Bi负载量上升,环己烯的转化率和环氧环己烷收率均呈现先上升后下降的变化趋势,而环氧化选择性在38%~40%上下波动,综合考虑,认为在Bi负载量0.5%时环氧化效果较优,环己烯转化率达到41.8%,环氧化选择性为38.3%,环氧化收率为16.0%,这说明对于二元金属Bi而言,其与Au、PMo11的较佳协同作用负载点也为0.5%。
考虑到环氧化选择性对于选择性催化氧化的重要性,本文认为选择负载0.5%的Bi作为二元金属较合适,即催化剂1%Au-0.5%Bi/PMo11/ZSM-5-m,在催化环己烯环氧化时不仅有较高的转化率,并且能达到较高的环氧环己烷选择性。
3.2.3 不同金属多氧酸盐对催化性能的影响
在上述实验条件下,改变金属多氧酸盐POMs的种类制备催化剂,考察不同的POMs对催化剂催化环己烯环氧化效果的影响,结果如表2所示。
表2 不同金属多氧酸盐对催化剂催化环氧化环己烯性能的影响
Table 2 Effects of POMs on the epoxidation of cyclohexene
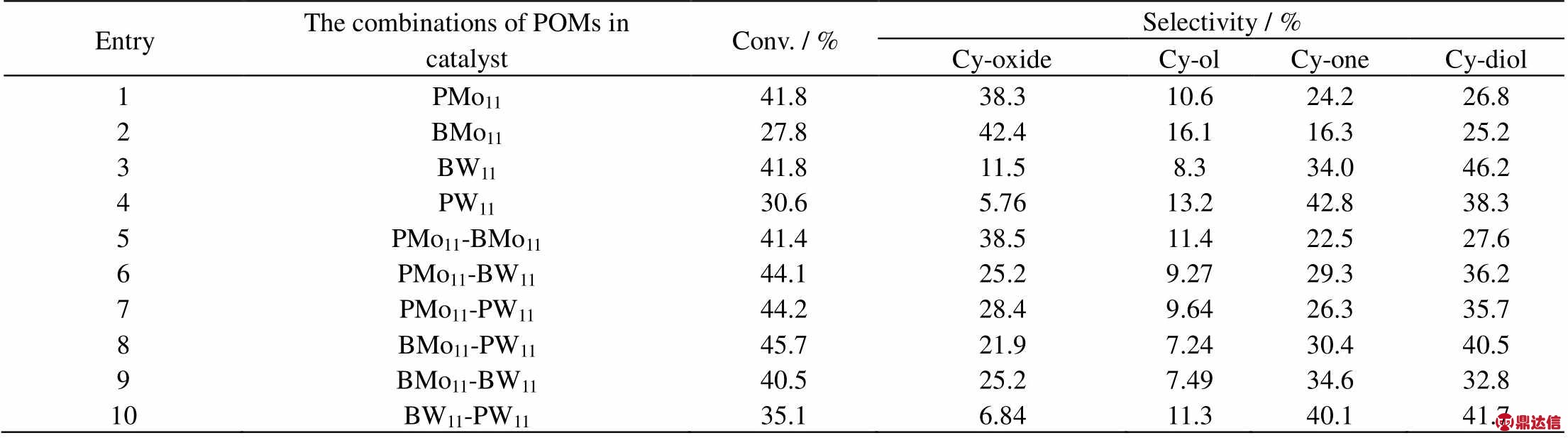
Reaction conditions: catalyst 0.02 g, cyclohexene 2.0 g, TBHP 3 drops, pressure 0.8 MPa, temperature 80 ℃, reaction time 18 h. In the 5~10 experimental groups, the total POMs loading content is w=6.67 %, the mass ratio of two POMs is 1:1
由表可知,POMs单一负载环氧化选择性以选用BMo11较高,而环己烯转化率和环氧环己烷收率则亦PMo11较好,BW11和PW11的催化环氧化效果较差,更偏向烯丙位氧化,这说明配原子为Mo的POMs比W的更易于催化分子氧环氧化环己烯,而W则更偏向烯丙位的氧化反应,并且也可看到,杂原子为B的POMs比P对于副反应的抑制作用更强,对环氧环己烷选择性的提升更有利。
由表2中5~10组的结果可以看到,两两混合实验组中组5效果较各组更优,达到41.8%的环己烯转化率及38.5%的环氧化选择性,相对仅负载BMo11的实验组具有更高的转化率和环氧化收率,相对仅负载PMo11的实验组而言,其烯丙位选择性(Cy-ol + Cy-one)更低,对于调节反应条件提升环氧环己烷选择性和收率更有潜力。以下针对负载型金属多氧酸盐杂化催化剂1%Au-0.5%Bi/PMo11-BMo11/ZSM-5-m对环己烯环氧化反应条件的影响进行考察。
3.2.4 不同反应条件对催化性能的影响
通过改变反应压力、温度、时间、催化剂添加量来考察3.2.3节所述的负载型金属多氧酸盐杂化催化剂1%Au-0.5%Bi/PMo11- BMo11/ZSM-5-m上各反应条件对催化环己烯环氧化效果的影响。
在反应温度80 ℃、催化剂0.02 g (环己烯2.0 g)、3滴TBHP、反应时间18 h条件下,考察反应压力对分子氧催化环氧化环己烯的影响,结果如图8所示。随着反应压力的增加,环己烯转化率先上升后趋于平缓,而环氧化选择性则一直呈现下降趋势。一开始转化率和环氧化收率出现大幅的提升可能是由于反应体系溶氧能力及分子氧和TBHP的协同氧化作用产生的,当压力由0提升至0.2 MPa时,转化率由7.45%提升至35.1%;随后由于体系溶氧能力下降甚至达到饱和,所以转化率和收率的增加开始趋于平缓,而氧压的进一步增加促进了副反应,所以环氧环己烷选择性出现了明显的下降。在压力达到0.5 MPa后,溶氧能力和TBHP协同效应对环氧化反应的增益显著减弱,而压力升高却使环氧化选择性开始明显下降。所以,该体系较合适的反应压力为0.5 MPa。
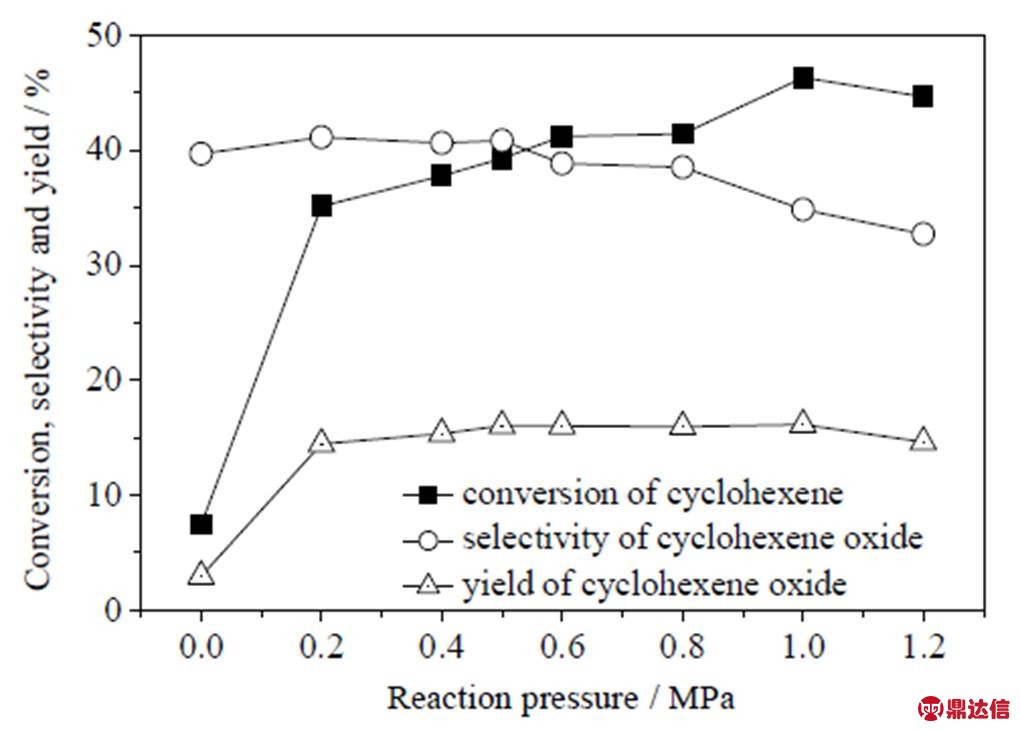
图8 反应压力对分子氧催化环氧化效果的影响
Fig.8 Effects of reaction pressure on the epoxidation of cyclohexene (0 MPa does not mean vacuum, which means no oxygen added)
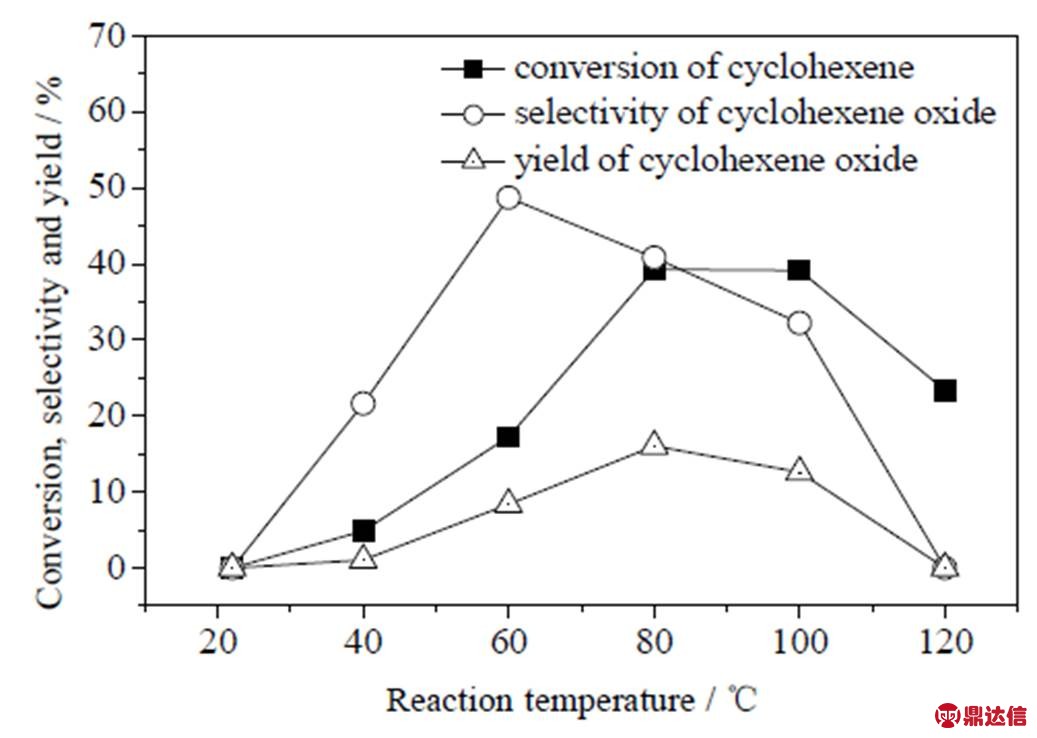
图9 反应温度对分子氧催化环氧化效果的影响
Fig.9 Effect of reaction temperature on the epoxidation of cyclohexene
在反应压力0.5 MPa、催化剂0.02 g (环己烯2.0 g)、3滴TBHP、反应时间18 h条件下,考察反应温度对分子氧催化环氧化环己烯的影响,结果如图9所示。环己烯转化率、环氧化选择性和收率均随着温度的升高而呈现先升高后下降的变化趋势。温度升高会逐渐使达到活化能的反应物分子增多,所以温度较低(室温~ 80 ℃)时,转化率、环氧化选择性和收率均随着温度升高而升高,其中转化率由0提升至39.3%;当温度进一步升高,由于环己烯的分压在体系中无法再被忽略(环己烯饱和蒸汽压100 ℃时为0.16 MPa,而80 ℃对应仅0.094 MPa),所以相对的,分子氧的分压明显减小,从而使转化率和收率明显下降,而温度升高同时也加剧了副反应的进行,因此环氧化选择性也出现下降的现象。综合考虑,认为催化剂催化环己烯环氧化较合适的反应温度为80 ℃。
在反应温度80 ℃、压力0.5 MPa、催化剂0.02 g (环己烯2.0 g)、3滴TBHP条件下,考察反应时间对分子氧催化环氧化环己烯的影响,结果如图10所示。随着反应时间的增加,转化率和环氧化收率曲线均是先增加后趋于平缓,而环氧化选择性则一直呈现下降的现象。反应时间从6 h延长至24 h,转化率由20.0%增加至46.0%,但环氧化选择性却由45.7%下降至36.1%,这说明反应时间的延长确实有利于环己烯的转化,但副反应也会同时进行,所以反应时间过长对于环氧化是不利的。因此,综合考虑选择性和转化率之下,本文采用18 h进行考察。
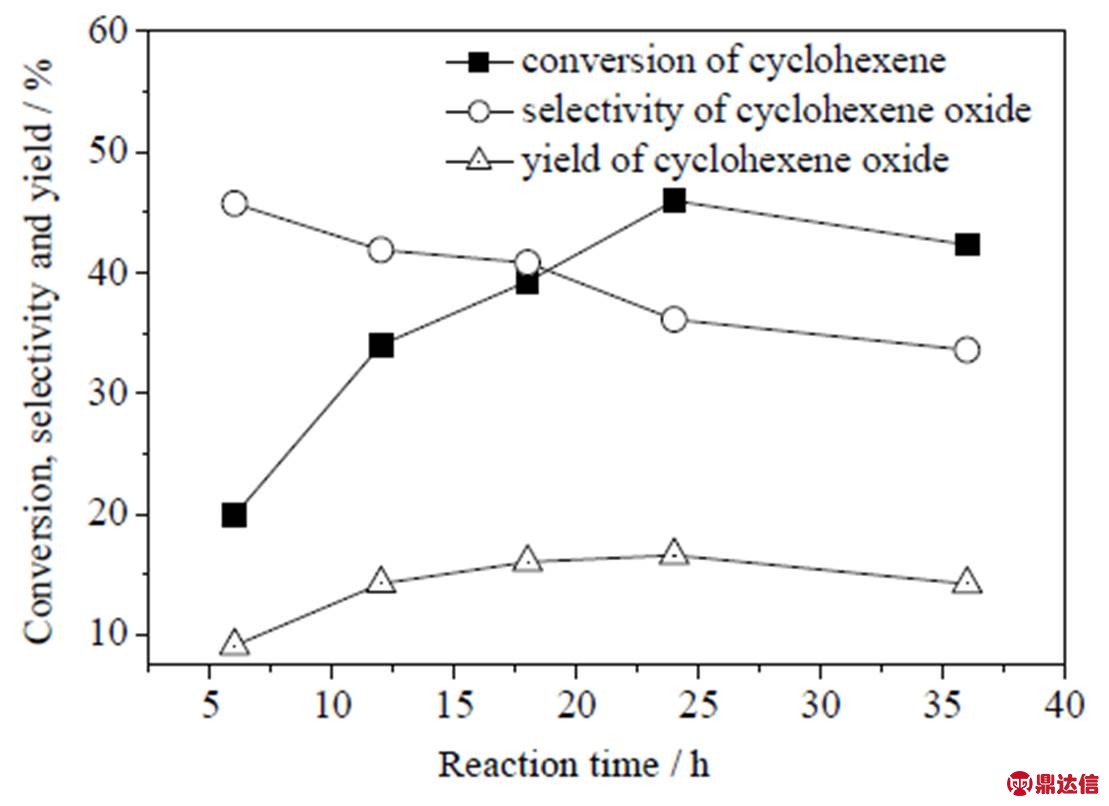
图10 反应时间对分子氧催化环氧化效果的影响
Fig.10 Effects of reaction time on the epoxidation of cyclohexene
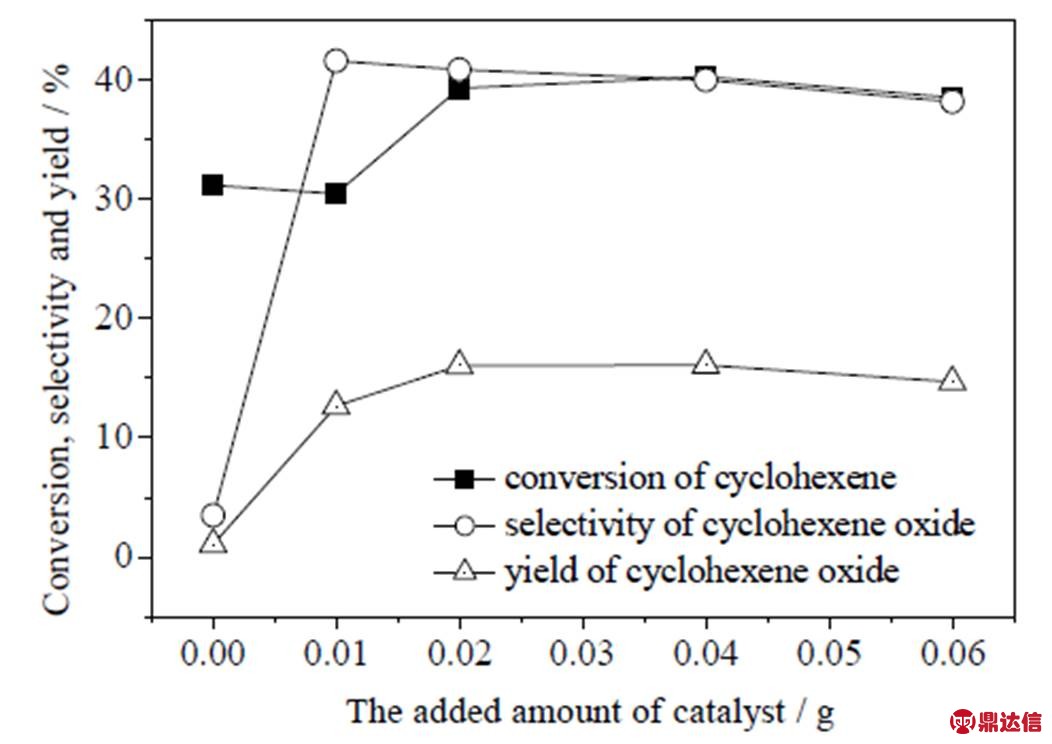
图11 催化剂添加量对分子氧催化环氧化效果的影响
Fig.11 Effects of reaction time on the epoxidationof cyclohexene
在反应温度80 ℃、压力0.5 MPa、环己烯2.0 g、3滴TBHP、反应时间18 h条件下,考察催化剂添加量对分子氧催化环氧化环己烯的影响,结果如图11所示。由图可知,转化率、环氧环己烷选择性和收率均随着催化剂添加量的增大而出现先增加后趋于平缓的现象。其中环氧环己烷选择性变化最为明显,在催化剂添加量由0增加至0.01 g时,选择性由3.48% 提升至41.6%。根据曲线图并综合考虑环己烯转化率、环氧环己烷选择性及催化剂成本,认为催化剂较合适的添加量为0.02 g。
综上,对催化剂1%Au-0.5%Bi/PMo11-BMo11/ZSM-5-m上反应条件对催化分子氧环氧化环己烯进行考察,得到较优的反应条件为反应压力0.5 MPa、反应温度80 ℃、反应时间18 h、催化剂添加量0.02 g (对应环己烯2.0 g,3滴TBHP),此时可达到39.3%的环己烯转化率及40.9%的环氧环己烷选择性。
3.2.5 催化剂的循环试验
采用上述较优条件:反应压力0.5 MPa、反应温度80 ℃、反应时间18 h、催化剂添加量0.02 g (对应环己烯2.0 g,3滴TBHP),进行环己烯环氧化反应催化剂稳定性考察。当反应结束后,将离心后的固体用丙酮洗涤2~3次,在80 ℃且通风条件下干燥12 h,得到的催化剂用于下一次实验,实验结果如表3所示。从表中可看到,催化剂在循环使用过程中环氧化选择性一直维持在40%左右,稳定性较好;催化剂在循环利用2次时,催化环氧化效果变化不大,但是当循环利用达3次以上时催化活性(转化率)开始明显下降。而经实验发现,经过高温焙烧后的负载型金属多氧酸盐催化剂的催化环氧化活性会出现明显下降(猜测可能是POMs高温分解造成的),因此可排除焙烧这个因素的影响。综合分析产生这个现象的原因可归结为:催化剂在多次反应、洗涤过程中由于磁子搅拌等作用发生破碎或者使活性中心如Au和POMs损失失活,也可能是由于离心过程出现颗粒聚结导致催化剂比表面积明显减小造成的。
表3 催化剂1%Au-0.5%Bi/PMo11-BMo11/ZSM-5-m的循环实验结果
Table 3 Reusability results of catalyst 1%Au-0.5%Bi/PMo11-BMo11/ZSM-5-m

Reaction conditions: catalyst 0.02 g, cyclohexene 2.0 g, TBHP 3 drops, pressure 0.5 MPa, temperature 80 ℃, reaction time 18 h
4 结 论
(1) 对于二元金属负载杂化,采用混合甲醛还原法分别负载二元金属Co、Bi较合适;二元金属选择Bi所制备的催化剂催化环氧化选择性和转化率较优,且较佳表观负载量为0.5%。
(2) 金属多氧酸盐POMs单一负载制备的催化剂中,以BMo11催化选择性较好,以PMo11催化活性较高;PMo11和BMo11混合使用对烯丙位氧化反应有一定的抑制效果,对提升环氧化选择性和转化率更有利。
(3) 以催化剂1%Au-0.5%Bi/PMo11-BMo11/ZSM-5-m对分子氧催化环氧化环己烯的较佳反应条件为:反应压力0.5 MPa、反应温度80 ℃、环己烯2.0 g、3滴TBHP、催化剂0.02 g、反应时间18 h,此时环己烯转化率可达39.3%,环氧环己烷选择性为40.9%。催化剂在多次循环使用后,其环氧化选择性基本维持不变,但在循环使用3次及以后,转化率明显下降,因此催化剂的稳定性还需要通过改变催化剂的制备方式及结构进一步提高。



