摘要:设计合成了3种[ONSO]型金属铝配合物,通过核磁共振氢谱(1H-NMR)、傅里叶变换红外光谱仪(FT-IR)、紫外可见分光光度计(UV-vis)和液质联用仪(HPLC-MS)对金属铝配合物进行了表征。将其作为催化剂考察在环氧环己烷(CHO)和邻苯二甲酸酐(PA)聚合反应中的催化行为。使用配合物1详细考察了聚合时间、反应温度等条件对聚合反应活性的影响,所得聚合物采用1H-NMR、FT-IR和凝胶渗透色谱(GPC)进行表征。结果显示,所得聚合物聚醚含量为98%,单位时间内每摩尔催化剂转化的单体数 (TOF)最高可达2475 h-1,Mw最高可达3.2×105,相对分子质量分布最低为2.0,聚合反应动力学研究结果表明,该聚合反应对单体呈一级反应,活化能为13.91 kJ/mol。
关键词:环氧环己烷;配合物;聚醚;催化;相对分子质量分布
聚醚具有高极性和柔韧性的特点,是热塑性弹性体中柔顺段的重要组成部分。由于环氧化合物和酸酐具有结构多样、种类繁多的特点,用于引发环氧化合物开环聚合反应的催化剂一直是研究的热点。大多数环醚可以通过亲电试剂诱导发生开环聚合反应来制备[1],环氧环己烷是石油化工行业的一种重要中间体,通过引发剂使环氧环己烷开环聚合能够得到主链带有刚性脂环状结构的聚醚。Robert[2]以卟啉-锰为催化剂,在110 ℃,CHO与催化剂的摩尔比1000∶1,反应72 h后,得到了痕量的聚合物。Thiam[3]等以软碱硫原子和氧原子为配位原子合成的铝配合物可以有效催化环氧乙烷(EO)开环聚合,但单体的转化率较低。金属铝配合物在环氧化合物与酸酐[4]或CO2[5]和内酯[6,7]开环共聚以及环醚[8]开环均聚反应中都表现出良好的催化活性。
类Salen及其衍生物配体结构多样,形成的配合物作为催化剂使用时,不仅其位阻效应和电子效应可以通过改变苯酚环取代基团、轴向阴离子和桥连基团来调节,而且合成方法较简单、催化效率较高。本文设计合成了3种以氮原子、硫原子和氧原子为配位原子的金属铝配合物(见Fig.1),该催化剂以金属铝作为活性中心,具有结构多样性和配位点较多的特点,用于CHO和PA的聚合反应中,并以催化剂1为例,对聚合反应动力学做了进一步的探究。
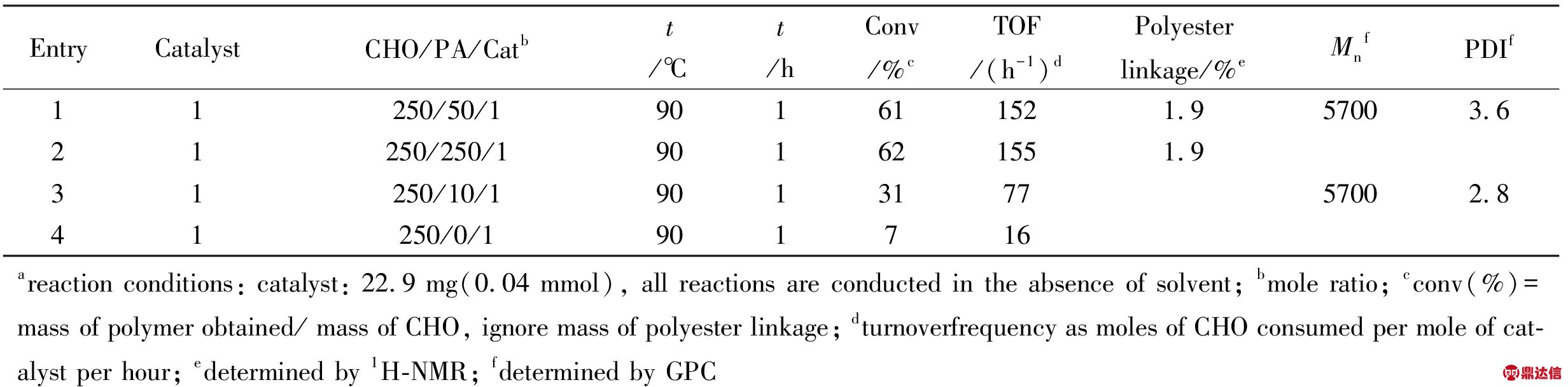
Fig.1 Complexes 1, 2, 3 employed in this study
1 实验部分
1.1 试剂与仪器
氯化二乙基铝(Et2AlCl):1 mol/L正己烷溶液,研峰科技(北京)有限公司;3,5-二氯水杨醛:分析纯,天津希恩思生化科技有限公司;3,5-二叔丁基水杨醛:分析纯,天津恒山化工科技有限公司;四氢呋喃:分析纯,氩气保护下加入金属钠-二苯甲酮回流变蓝后蒸出使用,天津恒山化工科技有限公司;二氯甲烷:分析纯,用氢化钙(CaH2)干燥重蒸后使用,天津恒山化工科技有限公司;环氧环己烷:分析纯,用氢化钙(CaH2)干燥重蒸后使用,天津市风船化学试剂科技有限公司;邻苯二甲酸酐:分析纯,经三氯甲烷重结晶后干燥使用,天津市科锐思精细化工有限公司。
紫外可见分光光度计(UV-CARY300):扫描范围800~200 nm;傅里叶交换红外光谱仪(Bruker Vector-22):分辨率:4 cm-1,扫描范围4000~400 cm-1;核磁共振波谱仪:Bruker AC 400型,扫描频率:400 MHz,扫描范围0~12 δ,德国Bruker公司; LCQ Advantage液质联用仪:ESI模式,4.8 kV喷雾电压,0.24 μA喷雾电流,毛细管温度230 ℃,Thermo-Finnigan公司;凝胶渗透色谱仪(PL-GPC 220):PS标样,THF流动相,1 mL/min,40 ℃,柱子为MIXED-B 300×7.5 mm,样品浓度为5 mg聚合物/5 mL THF,检测器UV 245 nm,德国Polymer Lab公司。
Scheme 1 Synthetic routes for the complexes 1-3
1.2 配体的合成
1.2.1 配体L1的合成[9]:氩气保护下向250 mL双口瓶中加入40 mL四氢呋喃、3,5-二叔丁基水杨醛(40.04 mmol)、半胱氨盐酸盐(40.0 mmol)和三乙胺(40.47 mmol)搅拌溶解,升温至70 ℃回流反应5 h,停止反应。静置冷却至室温,依次加入三乙胺(39.90 mmol) 和2,4-二叔丁基-6-溴甲基苯酚(40.0 mmol)四氢呋喃(20 mL)溶液,继续室温反应4 h,抽滤,减压蒸发溶剂得粗产物,重结晶(正己烷和无水甲醇的体积比为1∶20),产物收率为59.8%。1H-NMR (400MHz, CDCl3): (δH): δ1.27~1.43(m, 36H, C(CH3)3),δ2.70~2.74(t, 2H, CH2), δ3.65~3.68(t, 2H, CH2), δ3.84(s, 2H, Ar-CH2-S), δ6.95(d, 1H, Ar-H),δ7.08(d, 1H, Ar-H), δ7.25(d, 1H, Ar-H), δ7.39(d, 1H, Ar-H), δ8.29(s, 1H, Ar-CH=N)。UV-vis: 229 nm, 263 nm, 332 nm。FT-IR, ν/cm-1: 1274 cm-1(s, Ar-O), 1483 cm-1(s, Ar, C=C), 1629 cm-1(s, C=N), 2957 cm-1 (vs, CH2, CH3), 3330 cm-1 (b, -OH)。
1.2.2 配体L2的合成:氩气保护下向250 mL双口瓶中加入40 mL四氢呋喃和半胱氨盐酸盐(20.01 mmol),搅拌,然后在冰浴下滴加3,5-二氯水杨醛(20.05 mmol)的四氢呋喃(20 mL)溶液。室温反应3 h,停止反应。静置,依次加入三乙胺(20.1 mmol)和2,4-二叔丁基-6-溴甲基苯酚(20.02 mmol)的四氢呋喃(20 mL)溶液,继续室温反应2 h。抽滤,减压蒸发溶剂得粗产物,柱层析分离(石油醚∶乙酸乙酯=40∶1),产物收率为58.6%。1H-NMR (400 MHz, CDCl3): (δH):δ1.28(s, 9H, -C(CH3)3), δ1.41(s, 9H, -C(CH3)3), δ2.73~2.76(t, 2H, -CH2-S), δ3.67~3.71(t, 2H, N-CH2-),δ3.83(s, 2H, Ar-CH2-S),δ6.93(d, 1H, Ar-H), δ7.15(d, 1H, Ar-H), δ7.28(d, 1H, Ar-H), δ7.41(s, 1H, Ar-H),δ8.19(s, 1H,Ar-CH=N)。UV-vis: 229 nm, 260 nm, 335 nm。FT-IR,σ/cm-1: 1287 cm-1(s, Ar-O), 1454 cm-1(s, Ar, C=C), 1636 cm-1(s, C=N), 2956 cm-1(vs, CH2, CH3), 3328 cm-1(b, -OH)。
1.2.3 配体L3的合成:氩气保护下向250 mL双口瓶中加入40 mL四氢呋喃、3,5-二叔丁基水杨醛(30.03 mmol)和邻氨基苯硫酚(29.9 mmol)搅拌溶解,升温至70 ℃,回流反应2 h。静置冷却至室温,依次加入三乙胺(30.1 mmol)和2,4-二叔丁基-6-溴甲基苯酚(30.02 mmol)的四氢呋喃(20 mL)溶液,继续室温反应2 h。抽滤,减压蒸发溶剂得粗产物,重结晶(正己烷:无水甲醇=1∶20),产物收率:56.2%。1H-NMR (400 MHz, CDCl3): (δH,): δ1.20~1.49(s,36H, -C(CH3)3),δ4.13(s, 2H, Ar-CH2-S),δ6.83(d, 1H, Ar-H),δ7.11(d, 1H, Ar-H), δ7.14(d, 1H, Ar-H), δ7.18(d, 1H, Ar-H), δ7.22(d, 1H, Ar-H), δ7.28(d, 1H, Ar-H),δ7.36~7.45(d, 1H, Ar-H), δ7.48(d, 1H, Ar-H), δ8.58(s, 1H, Ar-CH=N)。UV-vis: 229 nm, 278 nm, 362 nm。FT-IR,σ/cm-1: 1270 cm-1(s, Ar-O), 1471 cm-1(s, Ar, C=C), 1614 cm-1(s, C=N), 2956 cm-1 (vs, CH2, CH3), 3419 cm-1 (b, -OH)。
1.3 配合物1~3的合成
氩气保护下向150 mL支口瓶中加入配体(1.1 mmol)和20 mL二氯甲烷搅拌完全溶解,在冰浴下缓慢滴加Et2AlCl的正己烷溶液(1.2 mL,1.2 mmol),滴加过程中有气体生成。随后缓慢升温至室温,并在室温下反应24 h,反应结束后在减压下蒸发掉溶剂,真空干燥得黄色配合物1~3。
1.3.1 配合物1:产率为98%。1H-NMR (400 MHz, CDCl3): (δH):δ1.28~1.52(m, 36H, -C(CH3)3), δ2.90~3.10(m, 2H, -CH2),δ3.93~3.96(m, 2H, CH2),δ4.13(s, 2H, Ar-CH2-S), δ7.01(d, 1H, Ar-H), δ7.11(d, 1H, Ar-H), δ7.31(d, 1H, Ar-H), δ7.64(d, 1H, Ar-H),δ8.50(s, 1H, Ar-CH=N)。UV-vis: 229 nm, 278 nm, 354 nm。FT-IR,σ/cm-1: 1268 cm-1(Ar-O), 1474 cm-1(Ar, C=C), 1626 cm-1(s, C=N), 2957 cm-1(vs, CH2, CH3)。ESI-MS (m/z): [M+H]+为573.2, Found为573.2。
1.3.2 配合物2:产率为99%。1H-NMR (400 MHz, CDCl3): (δH):δ1.27~1.51(s,18H,-C(CH3)3), δ3.01(t,2H,-CH2-S),δ3.90(t,2H,N-CH2-),δ4.20(s,2H,Ar-CH2-S),δ6.99(d,1H,Ar-H),δ7.11(d,1H,Ar-H),δ7.32(d,1H,Ar-H), δ7.63(s,1H, Ar-H),δ8.51(s,1H,Ar-CH=N)。UV-vis:229 nm,272 nm,348 nm。FT-IR,σ/cm-1:1275 cm-1(Ar-O),1452 cm-1(Ar, C=C),1632 cm-1(s, C=N), 2956 cm-1(vs,CH2,CH3)。ESI-MS(m/z): [M-Al-Cl+H]+为468.39,Found为468.15。
1.3.3 配合物3:产率为98%。1H-NMR(400 MHz, CDCl3):(δH): δ1.29~1.55(s,36H, -C(CH3)3),δ3.98~4.13(s,2H,Ar-CH2-S),δ6.94(d,1H,Ar-H), δ7.15(d, 1H,Ar-H),δ7.18(d,1H, Ar-H),δ7.22(d,1H,Ar-H),δ7.31(d,1H,Ar-H), δ7.35(d,1H,Ar-H), δ7.48~7.51(d,1H,Ar-H), δ7.70(d, 1H, Ar-H),δ8.71(s, 1H, Ar-CH=N)。UV-vis: 229 nm, 284 nm, 392 nm。FT-IR,σ/cm-1: 1259 cm-1(Ar-O),1466 cm-1(Ar, C=C),1611 cm-1(s, C=N),2956 cm-1(vs, CH2, CH3)。ESI-MS (m/z):[M-Al-Cl+H]+为560.8, Found为 60.3。
1.4 CHO与PA的聚合反应
称取一定量的催化剂和酸酐(PA)加入到25 mL反应管中,45 ℃油浴加热抽真空干燥2 h。氩气保护下加入相对应量的CHO,转移至预设温度的油浴锅中进行反应。停止反应后倒入60 mL甲醇中静置,过滤,并用甲醇洗涤滤饼3次,将得到的固体产物置于60 ℃真空干燥箱中干燥至恒量,称量计算收率。
2 结果与讨论
2.1 实验条件对聚合反应的影响
将含有不同骨架结构的3种[ONSO]AlCl配合物用于CHO和PA的聚合反应中,随后以配合物1为例,详细考察了不同反应条件对催化剂活性及聚合物相对分子质量的影响。
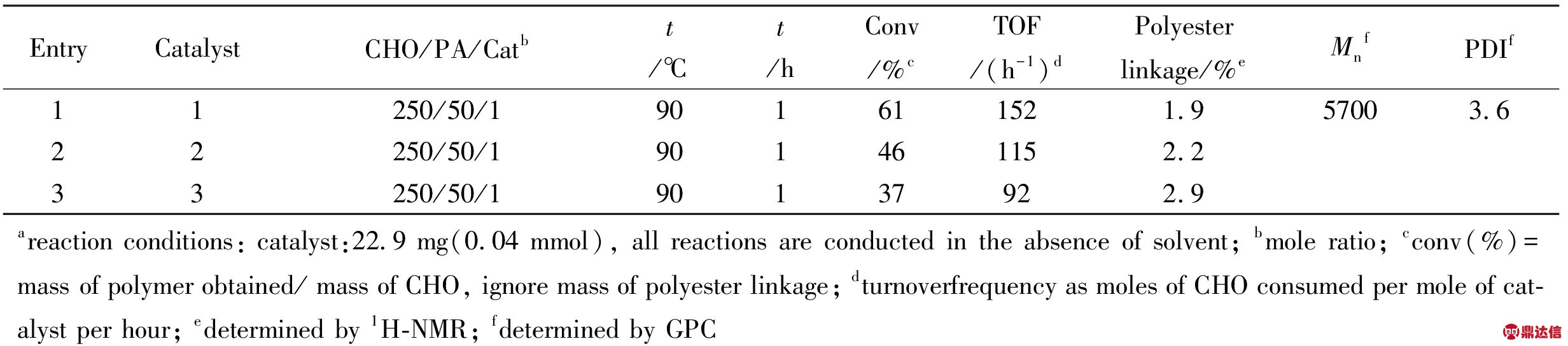
2.1.1 催化剂结构对聚合反应的影响: 为考察催化剂结构对CHO聚合反应活性的影响,做了对比实验,实验结果见Tab.1。在相同条件下,带有给电子基团且通过乙基桥连的金属配合物1的活性最高,同样通过乙基桥连但带有吸电子基团的配合物2次之,通过苯环桥连的配合物3催化活性最低。这可能是因为吸电子基团(-Cl)的存在和苯环与硫原子形成的P-π共轭降低了硫原子上孤对电子与金属的配位,致使金属中心上电子云密度降低,催化剂活性呈现降低的趋势。
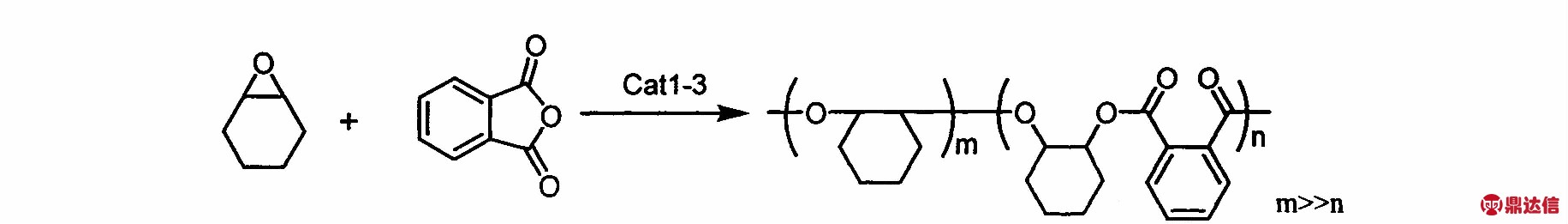
Scheme 2 Polymerization equation
Tab.1 Effect of different catalyst for polymerization of CHOa
2.1.2 酸酐加入量对聚合反应的影响: 酸酐的量对CHO聚合反应产率的影响,如Tab.2所示。PA加入量的改变对CHO聚合反应的产率等都有影响。在反应体系中,单独使用催化剂1时,转化率只有7%;只加PA时,没有任何催化活性。当同时加入PA和催化剂1时,转化率有很大的提高,为61%,说明PA可以提高催化反应活性。随着PA加入量的增加,收率呈现先增大后不变的趋势,进一步说明PA的加入量对聚合反应的收率和催化活性都有很大的影响,但聚合物相对分子质量没有发生变化,相对分子质量分布变宽,可见PA量的增加使得低相对分子质量聚醚生成增多。
Tab.2 Effect of PA proportion for polymerization of CHO under 1a

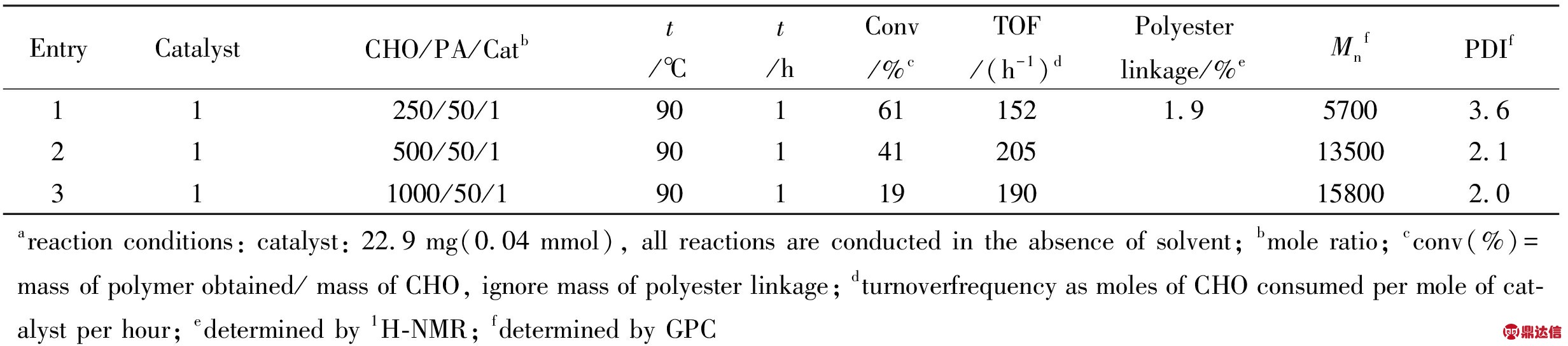
Tab.3 Effect of different mole ratio for polymerization of CHO under 1a

2.1.3 催化剂浓度对聚合反应的影响: 固定催化剂的量不变,改变CHO的量,间接改变了反应体系中催化剂的浓度,从而进一步探讨催化剂的浓度对聚合反应的影响,实验结果列于Tab.3。催化剂浓度较低时催化活性中心不足,因而随着催化剂浓度的增加,聚合物产量有一个上升的过程。而当继续增加催化剂的浓度时,由于催化活性中心过多,不利于聚合物相对分子质量的增加;各个催化中心竞争的结果是生成相对分子质量较小的聚醚。这也正是随着CHO/PA/1摩尔比的减小,催化活性先增大后减小的原因。
2.1.4 温度对聚合反应的影响: 对聚合反应来说,反应温度是至关重要的影响因素,实验结果列于Tab.4。在聚合反应前期,温度对聚合活性的影响比较显著,当温度由70 ℃升高至90 ℃时,催化活性急剧升高,TOF值由600 h-1升高至1290 h-1,继续升高反应温度至110 ℃,TOF值升至2475 h-1。然而随着反应温度的升高,聚合物的相对分子质量不断下降。聚合物的相对分子质量主要由链增长速率常数(kp)及链转移速率常数(ktr)的比值决定[10],一般链转移活化能高于链增长活化能,升高温度加快链转移速度,致使聚合物相对分子质量下降。
Tab.4 Effect of different temperature for polymerization of CHO under 1a
2.1.5 时间对聚合反应的影响: 反应时间对聚合反应活性的影响(如Fig.2所示)。由图可知,催化剂初始活性较高,在聚合时间为30 min之前,随着聚合时间的延长,聚合活性下降明显。聚合反应体系黏度增大以及单体数量减少,导致聚合活性的降低。结合Tab.4可知,继续延长反应时间,聚合活性的变化则趋于平缓。虽然聚合物的数均相对分子质量呈现下降的趋势,但是相对分子质量分布变宽,整体来说,重均相对分子质量基本保持不变。
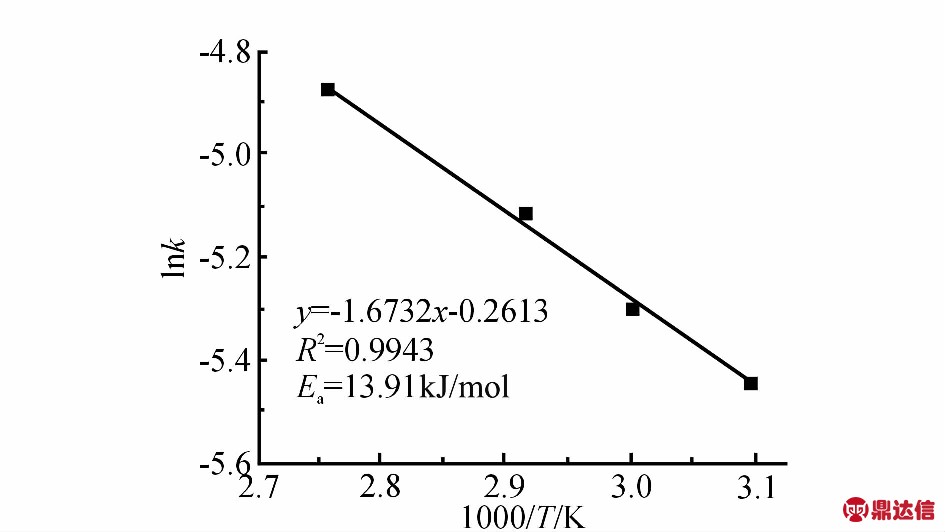
Fig.2 Effects of reaction time on the polymeration activity under complex 1
polymerization conditions: n(CHO)/n(PA)/n(1)=250/50/1; CHO: 0.98 g(10 mmol)
2.2 聚合产物的表征与分析
聚合物的红外光谱图如Fig.3所示。其中2936 cm-1, 2857 cm-1是亚甲基伸缩振动吸收峰,1725 cm-1是酯基吸收峰,1447 cm-1是亚甲基变形振动吸收峰,1087 cm-1是聚醚的特征吸收峰。
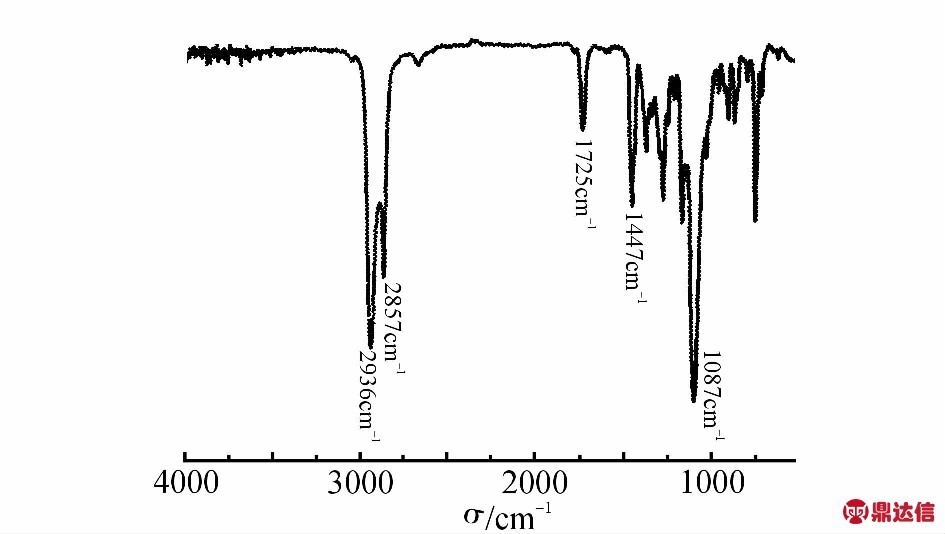
Fig.3 FT-IR spectrum of PCHO obtained by complex 1(Tab.1, Entry 1)
Fig.4为聚合物的核磁氢谱图。在图中δ1.0~2.2(m,8H)代表CHO开环后形成聚醚链段中所有亚甲基上H的化学位移,δ3.3~3.5(m,2H)代表CHO开环后形成聚醚链段中次甲基上H的化学位移,δ5.0(m,2H)代表CHO与PA聚合形成聚酯连接处的次甲基上H的化学位移,δ7.5~8.0(m, 4H)代表聚酯链段中苯环上H的化学位移,这与红外谱图中酯基吸收峰(1725 cm-1)保持一致,因此所得聚合物中含有聚酯链段,且含量为1.96%。在核磁谱图中,CHO开环后形成聚醚链段中次甲基上H的化学信号显示为3个峰,化学位移分别为δ3.3、δ3.4、δ3.5,这与文献[11]中保持一致,因此在PA存在下,配合物1引发聚合生成的PCHO是无规的,对CHO的开环聚合并不具有选择性。

Fig.4 1H-NMR spectrum of PCHO generated by complex 1(Tab.1, Entry 1)
complex 1: 22.9 mg(0.04 mmol); 90 ℃
2.3 聚合反应动力学分析
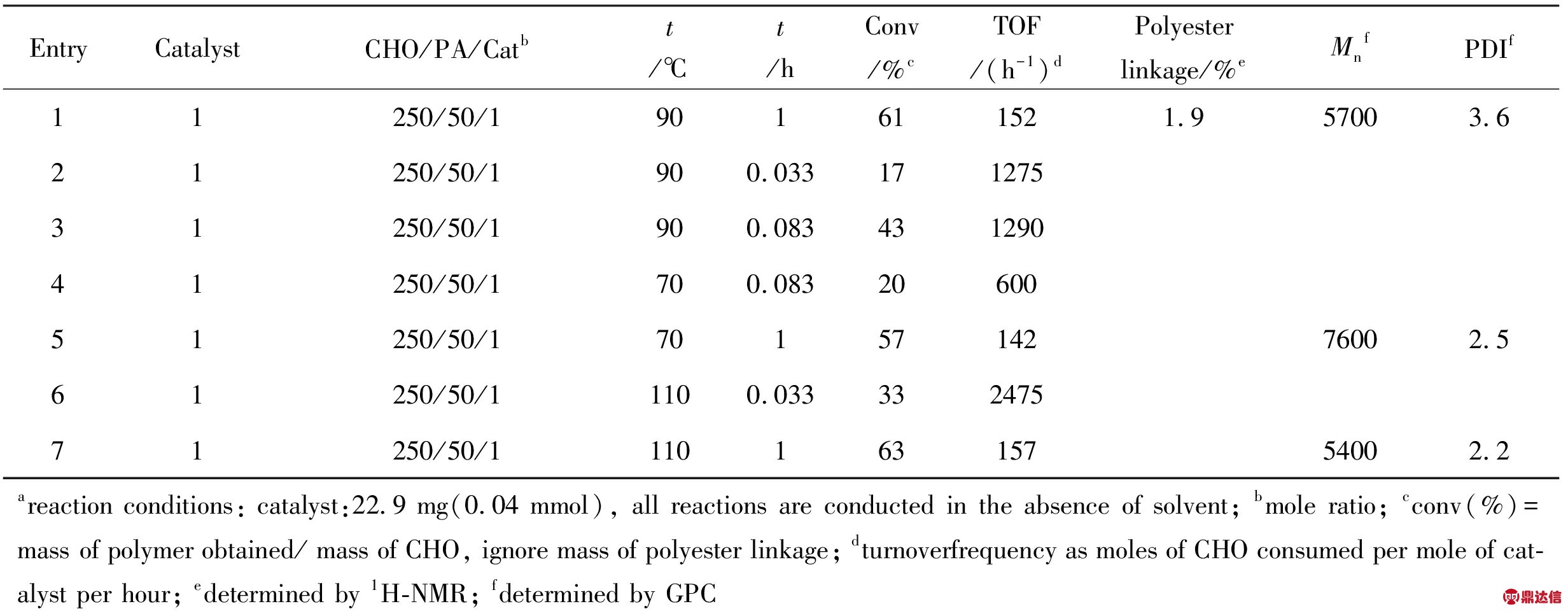
以配合物1为例,在相同(CHO/PA/1=250/50/1)条件下,分别做了不同温度、不同时间的实验,聚合物(PCHO)收率与时间的关系如Fig.5所示。ln[M]0/[M]t与时间(t)呈线性关系,表明聚合对单体呈一级反应。Fig.6为不同反应温度下的反应速率常数(k)对温度(T)的作图,可以看出,lnk与1000/T呈线性关系。根据此直线的斜率,用Arrhenius公式可求得该聚合反应的表观活化能为13.91 kJ/mol。
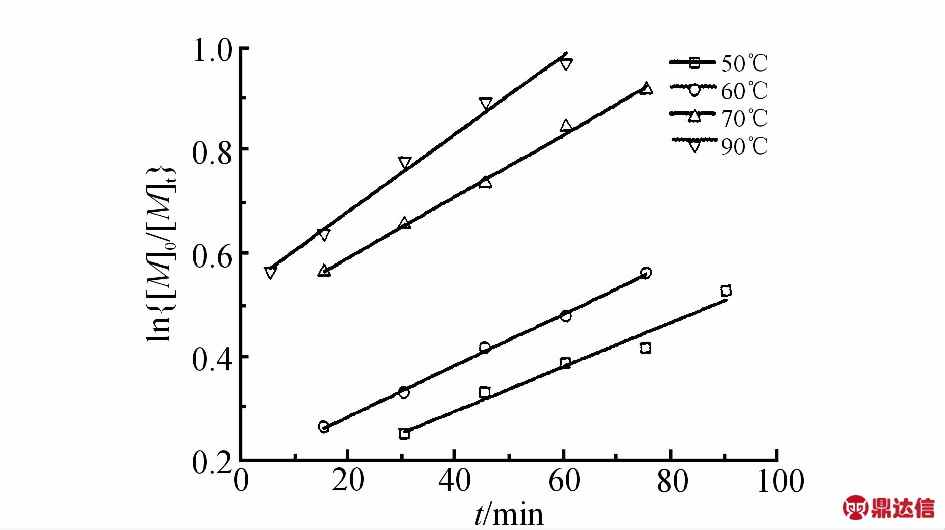
Fig.5 Dependence of polymer yield on reaction time
2.4 聚合反应机理
为了进一步确定是酸酐与金属配合物作用引发的聚合反应,实验结果表明,加入催化剂当量的PA时,转化率为11%;同样用催化剂当量的邻苯二甲酸替换PA,在相同条件下催化CHO聚合,反应停止后加入无水甲醇,略显浑浊,并不能分离出聚合物;对比实验结果可知在反应过程中是酸酐与催化剂1形成阳离子而后引发CHO聚合。

Fig.6 Dependence of polymerization rate on reaction temperature
由上述实验数据和结果可知,该聚合反应的反应机理是阳离子聚合中的活性链端聚合[12,13],聚合产物的结构也证明了这一点[14]。根据文献[15]报道,在PA存在下,催化剂1催化CHO聚合的机理如Fig.7所示。结合不同酸酐结构对聚合反应活性的影响,随着酸酐结构中电子云密度的降低,活性中心阳离子的稳定性降低,聚合反应活性下降。文献[16]已报道,在聚合反应中,聚合实验的产率达到61%之后,延长反应时间也不能继续提高。从实验现象来看,在聚合反应开始30 min后,反应液已固化,阻止了单体向活性中心的扩散[17],可以尝试对其他溶剂体系进行探索,以期降低反应后期聚合液的黏度,利于单体向活性中心的扩散。从反应机理来看,在阳离子聚合机理中,存在单体稳定活性中心阳离子的现象[18],这正是聚合产率无法继续提高的原因。
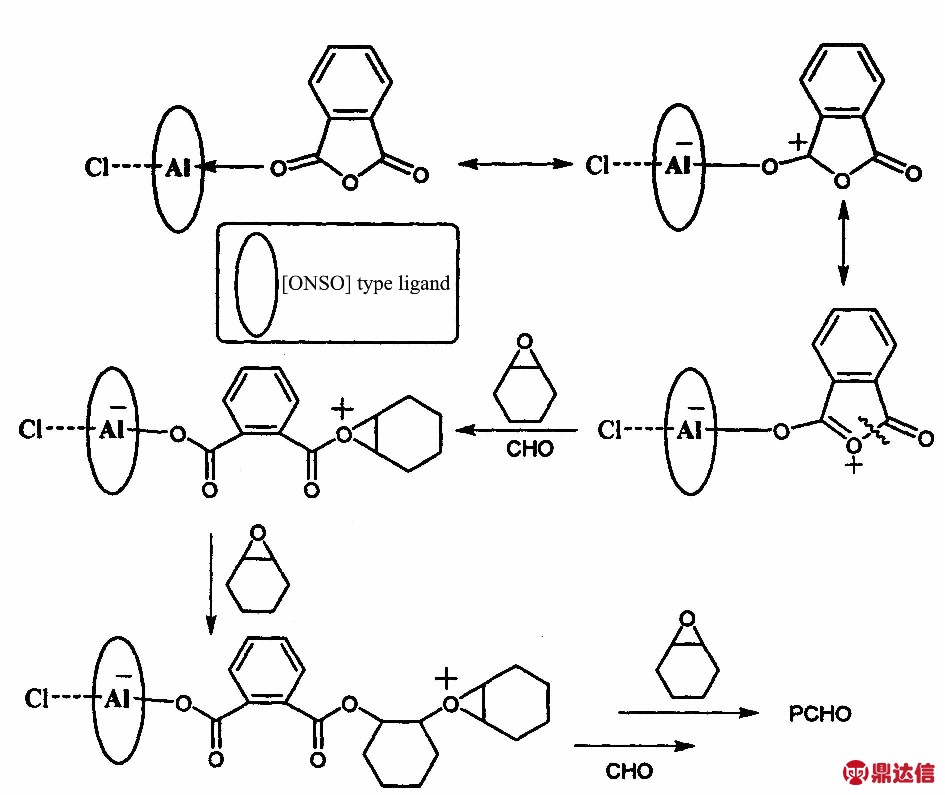
Fig.7 Mechanism of polymerization
3 结论
本文以S、N和O为配位原子,以金属铝为活性中心,合成了3种不同骨架结构的金属铝配合物,用于催化CHO与PA制备聚醚的反应,并对聚合反应动力学和聚合反应机理做了进一步的探究, 发现酸酐的加入对聚合反应有较大影响,其中催化剂1活性最好,在n[CHO]∶n[PA]∶n[1]=250∶50∶1,90 ℃下本体聚合反应1 h,收率达到61%,相对分子质量为5700,相对分子质量分布为3.6,所得聚合物PCHO链段含量为98%。聚合反应对单体呈一级反应,活化能为13.91 kJ/mol。这些结果为以后设计、制备新型催化剂并将其应用于环氧化合物开环聚合反应提供了思路和方法。



