摘 要:金属有机框架(MOFs)是一类新兴的材料,也称为配位聚合物,具有许多作为药物载体所需的特性,近年来已经成为药物存储和传递重要的候选材料。通常合成的纳米MOFs难以满足其在生物医学中的应用,通过表面修饰可以提高MOFs的稳定性和分散性,可以协助药物跨过生理障碍,实现MOFs的口服给药;另外通过表面改性也可以减缓MOFs的降解,实现缓释给药;通过进一步修饰还可以增加药物在特定部位的富集,实现靶向治疗。表面修饰对于MOFs药物传输系统的发展非常重要。近年来,比较常见的MOFs表面修饰材料有聚乙二醇、二氧化硅、环糊精、肝素、壳聚糖,以及其他靶向修饰材料,如叶酸、DNA、甘草次酸等。介绍了药物载体MOFs常见的表面修饰材料,及通过这些材料修饰后赋予MOFs的优良性能,并举例阐述了修饰后的MOFs在生物医药领域的应用前景,为MOFs作为药物载体的开发提供参考。
关键词:金属有机框架(MOFs);表面修饰;药物载体;药物传输系统;新兴材料
1 前 言
金属有机框架(metal organic frameworks, MOFs),是一类新兴的结晶微孔材料,是由金属离子或金属簇与有机桥连配体通过配位作用构筑出二维或三维的具有周期性网络结构的固体材料[1]。MOFs具有极高的比表面积、能够负载药物分子的大孔道、良好的生物降解性能,这些特点使得MOFs近年来成为药物载体重要的候选材料[2]。作为一种药物传递系统(drug delivery systems,DDSs),MOFs与其它有机DDSs和无机DDSs相比具有自身的潜在优势。有机DDSs(如脂质体和聚合物)具有较好的生物相容性,但药物有效载荷量较低,缺乏药物传递的控制率;无机DDSs(如金纳米粒、铁纳米粒和硅纳米粒等)虽然可以提供高载药量,能够以规定的速率传递药物,但是生物相容性差、降解率低,导致其积累在肝脏或脾脏,可能会产生一些副作用[3]。MOFs材料则结合了上面二者的优点[4],由金属离子(Fe,Zn,Cu,Co等)和有机链接剂(羧酸盐、咪唑酸盐、磺酸盐、磷酸盐等)自组装而成,并且有机链接剂能够在MOFs自组装过程中或之后进行表面功能化修饰[5],这也是MOFs的另一个优点。
对MOFs进行表面修饰可以有效控制DDSs的稳定性和分散性,调节MOFs与生物系统之间的关系,同时控制MOFs与细胞和组织靶向、细胞内化之间的关系[6]。通过表面修饰可以提高MOFs的稳定性和生物相容性;降低免疫应答,赋予MOFs隐身的性能;延长胃肠道滞留时间,提高对细胞膜的透过性;增强靶向性,减轻副作用;克服突释的行为,实现缓释给药;将治疗药物与成像方式相结合以显示给药位点[7];减轻癌症患者压力,实现口服给药。
2 MOFs表面修饰
MOFs表面修饰方法一般分为两种:共价键结合方式(即冷凝、点击化学和共轭反应)和非共价键结合方式(即静电相互作用、分散力和氢键)[8, 9],通常根据MOFs的表面性质和修饰分子的性质来决定选择何种方法。随着MOFs表面修饰方法的不断完善,各种不同功能的表面修饰材料也不断地被开发出来,MOFs作为药物载体扮演着日益重要的角色。以下将介绍几种常见的MOFs表面修饰材料。
2.1 聚乙二醇
聚乙二醇(polyethylene glycols,PEGs)作为MOFs的表面修饰材料,可以防止颗粒聚集、提高MOFs的分散性和稳定性[9]、减少血液蛋白对MOFs的氧化作用和单核吞噬系统中巨噬细胞对MOFs的吸收,使MOFs在血液中循环较长的时间,为靶向输送提供条件。在此基础上,PEGs还可以与其他具有靶向作用的分子链接,对人体的特定部位实现主动靶向给药。Lin等[10]报道了包覆脂质和PEGs的Mn-MOFs,通过包覆后再与靶向基团(对甲氧苯甲酰胺)链接,能够提高药物靶向性,显著增强其对人乳腺癌细胞和胰腺癌细胞的毒性,如图1a~1f所示。
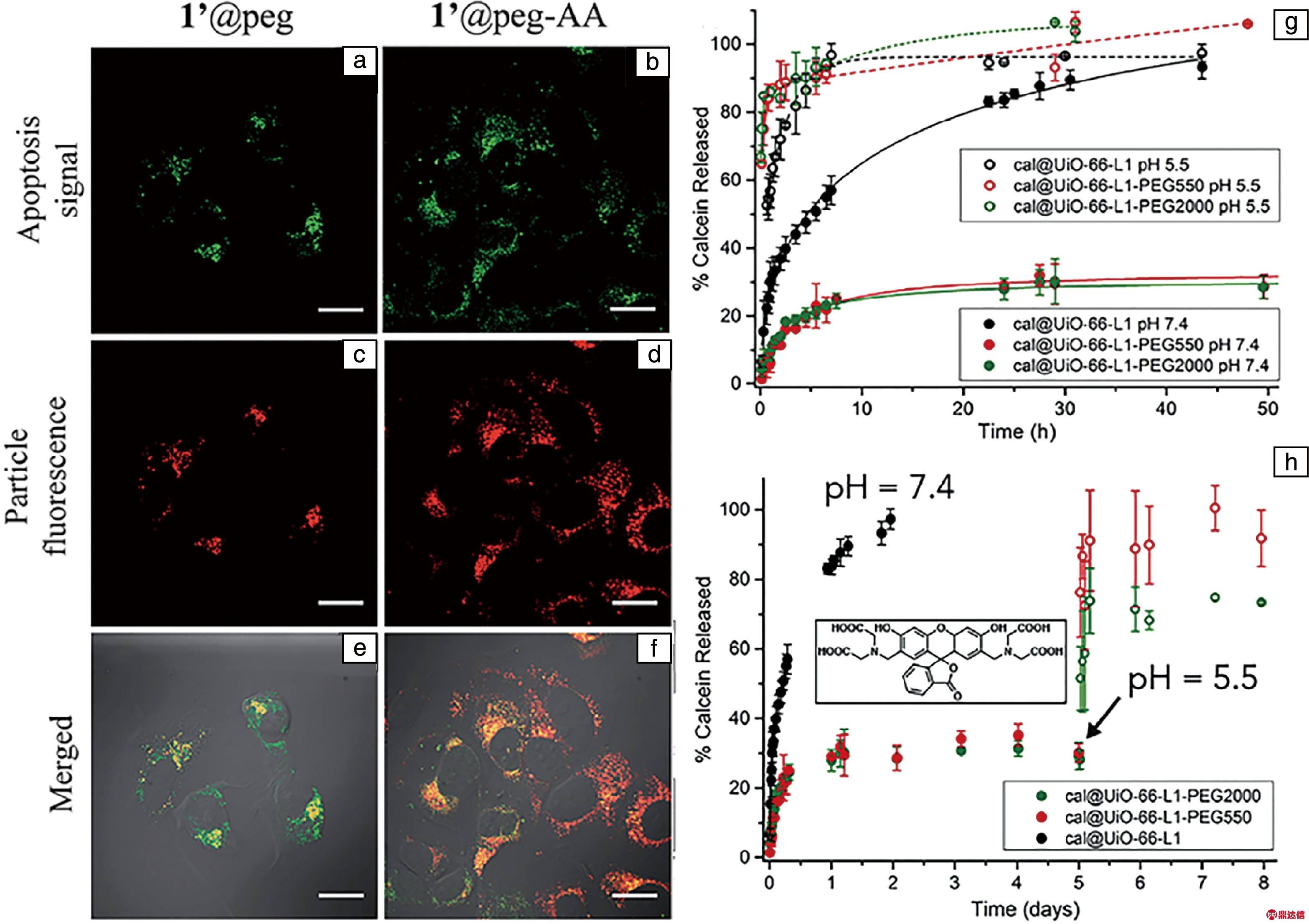
图1 共聚焦激光扫描显微镜下PEGs修饰的MOFs(a, c, e)和PEG-AA修饰MOFs(b, d, f)的MCF-7细胞培育照片,将靶向集团(AA)连接到修饰PEG的MOFs上,从而提高靶向性(标尺为20 μm)[10];钙蛋白在磷酸盐缓冲液中的释放图谱(g, h)[11]
Fig.1 MCF-7 cells cultured with PEGs-modified MOFs (a, c, e) and PEG-AA modified MOFs (b, d, f) under confocal laser scanning microscopy (CLSM), link the targeting group (AA) to MOFs modified with PEG to improve targeting, scale bars are 20 μm[10]; the release spectrum of calcium protein in phosphate buffers (g, h)[11]
此外,Forgan等[11]将PEGs共轭修饰到UiO-66表面,发现在pH值为7.4时,PEGs链能够增强MOFs对磷酸盐的稳定性,还可以克服突释的行为;在pH值为5.5时,则可以实现缓释给药,如图1g和1h所示。
PEGs具有很多优良的性能,但仍然存在一些潜在的缺点,例如,PEGs及其合成过程中引入的副产物可能会引起机体的过敏反应;经PEGs修饰的药物载体,其体内药动学行为可能会发生不可预测的变化;PEGs本身的不可生物降解性及其在有氧环境中的易降解特性都会对其使用产生不利的影响[12]。此外,有文献[13]报道PEGs还会侵入MOFs的骨架内,显著降低MOFs的多孔性,使之药物负荷能力下降,不受控地释放药物。
2.2 二氧化硅
经二氧化硅修饰后,MOFs的水分散性和化学稳定性得到了提高,还可以通过硅烷醇的缩合反应来进行进一步功能化[9]。2007年,Lin等首次报道可以通过溶胶-凝胶或微乳化方法将二氧化硅涂覆在纳米MOFs上,形成一系列纳米核壳复合材料,用于金属成分的控制释放和吡啶二羧酸的发光传感[14]。2008年,该团队采用二氧化硅表面修饰的MOFs包载抗癌药物,通过改变二氧化硅外壳的厚度有效地控制了药物的释放速率[15],如图2a所示。紧接着,该团队又发现二氧化硅包裹的MOFs经二氧化硅衍生物和罗丹明B功能化后,对血管新生癌细胞具有靶向性,同时具有核磁共振成像的潜力[16],图2b为细胞的核磁图像。共聚焦显微镜成像研究进一步证实,与无修饰的颗粒和非靶向基团修饰的颗粒相比,具有靶向基团修饰的颗粒摄取增强,如图2c~2e所示。
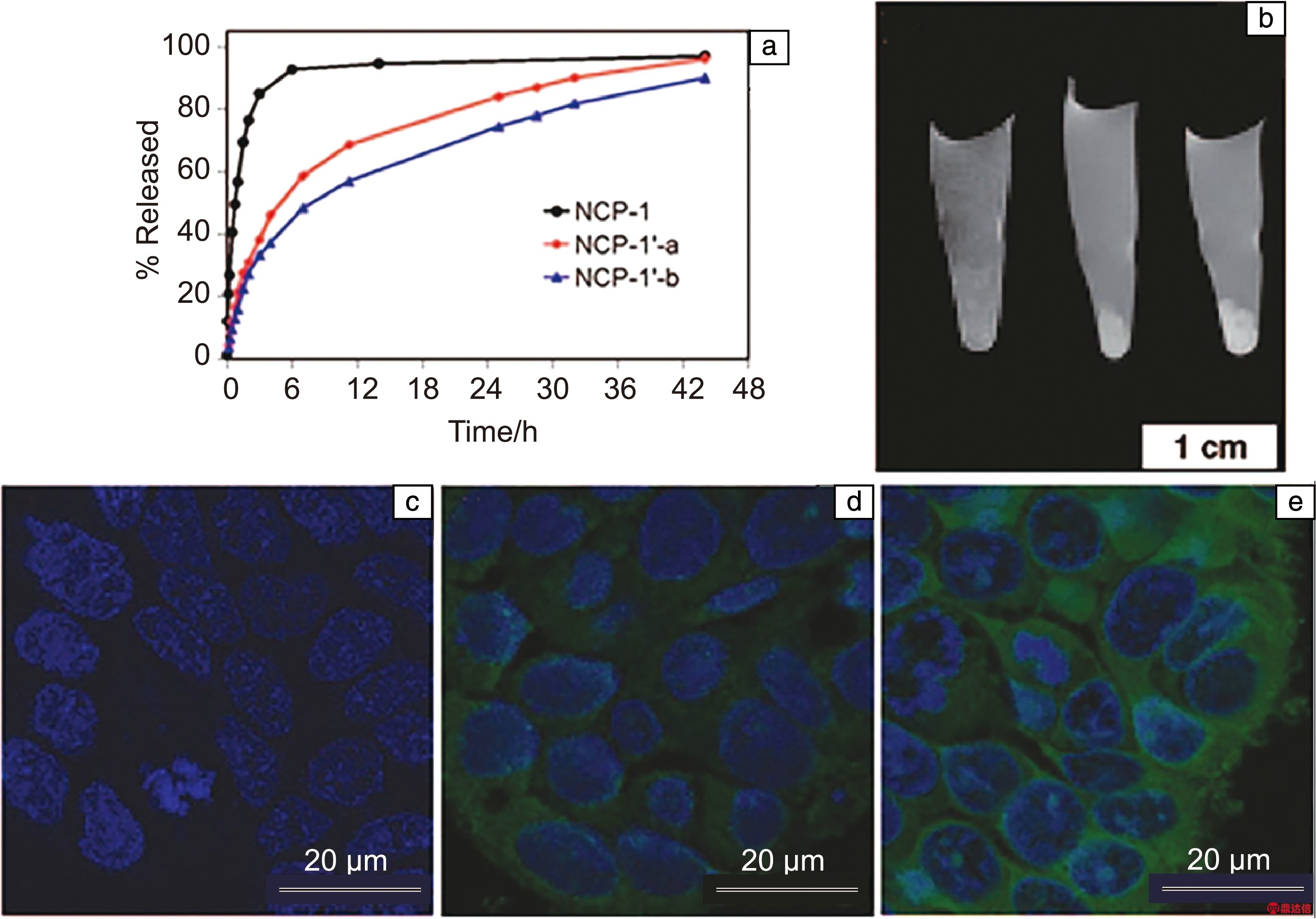
图2 不同厚度二氧化硅修饰MOFs的药物释放速率曲线(a)[15];HT-29细胞与无修饰的纳米MOFs(左)、非靶向基团修饰的纳米MOFs(中)、c(RGDfK)修饰的纳米MOFs(右)的核磁照片(b)[16];HT-29细胞与无修饰的纳米MOFs(c)、非靶向基团修饰的纳米MOFs(d)、c(RGDfK)修饰的纳米MOFs(e)的共聚焦激光扫描显微镜成像照片[16]
Fig.2 Drug release curves of MOFs modified by silica with different thickness (a)[15]; magnetic resonance imaging of HT-29 cells that were incubated with unmodified nano MOFs (left), nontargeted nano MOFs (middle), and c(RGDfK)-targeted nano MOFs (right) (b)[16]; CLSM imaging of HT-29 cells that were incubated with unmodified nano MOFs (c), nontargeted nano MOFs (d), and c(RGDfK)-targeted nano MOFs (e)[16]
然而,使用二氧化硅对MOFs进行表面修饰可能会使其堵塞MOFs的孔隙通道,而且研究发现二氧化硅纳米颗粒会导致肝、脾、肺的损伤[17],细胞毒性效应更高[6]。
2.3 环糊精
环糊精金属有机骨架(CD-MOFs)是一种对环境无污染、生物相容性好的药物载体,在药物传递系统中日益受到重视[18]。Agostoni等将带有磷酸酯的环糊精分子与纳米悬浮液一起孵育,对MOFs进行表面修饰,环糊精的包覆以及MOFs载药过程如图3所示,首先三价铁离子与三甲基磺酸反应制备MOFs,载药之后,采用环糊精进行表面修饰,由于环糊精体积大,封闭MOFs的孔径,药物不会流出,而其他的小体积的涂层材料无法阻塞MOFs的孔隙,导致药物释放失控。此外,该研究还发现环糊精涂层在体液中是稳定的,可以与PEGs相链接以逃避免疫系统,还可以通过靶向配体对环糊精进行进一步功能化修饰[19]。Golmohamadpour等将环糊精包覆的Fe-MIL-88B用羟基磷灰石进一步修饰,提高了载药量,并使药物能够缓慢释放[20]。
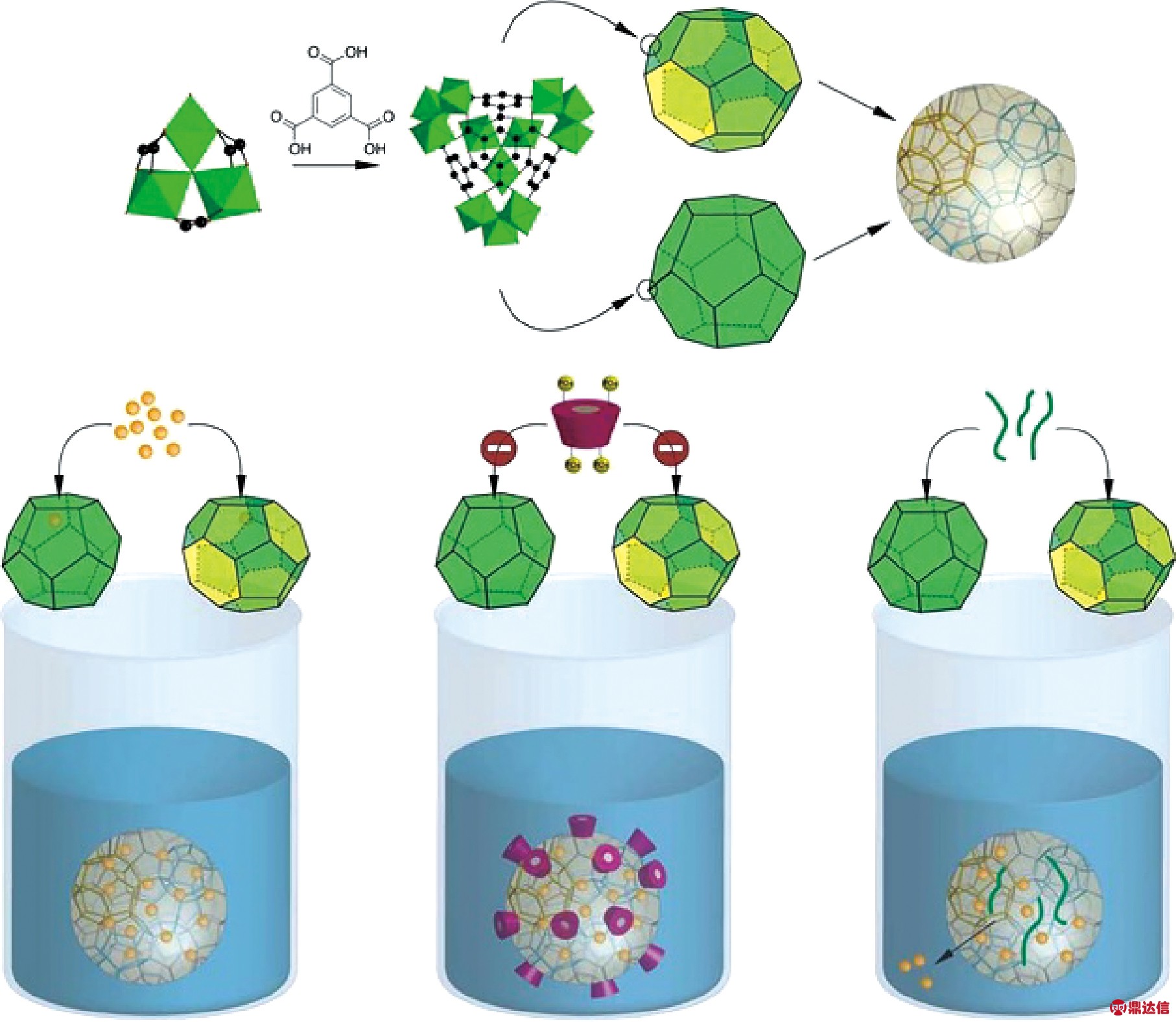
图3 环糊精的包覆以及MOFs载药过程示意图[19]
Fig.3 Schematic diagrams of cyclodextrin coating and MOFs loadingprocess[19]
2.4 肝素
肝素最初因其抗凝作用而广为人知,最近才被用作纳米粒子的表面修饰物[9]。肝素分子结构中存在多种化学基团(硫酸基、羧基、羟基),容易与MOFs表面发生相互作用,且肝素的分子尺寸较大,可以避免侵入MOFs的孔隙中。Bellido等[13]利用肝素对MIL-100(Fe)进行表面修饰,发现其在模拟的生理条件下表现出完整的晶体结构和孔隙度,稳定性有所提高,相比于未包覆的MOFs能够更加缓慢地释放药物,如图4a和4b所示。J774.A1细胞的共聚焦显微照片(图5)表明,经过1 h或4 h的短期培养,未涂覆肝素的MIL-100(Fe)纳米粒子细胞渗透速度很快,肝素包覆的MIL-100(Fe)纳米粒子的细胞摄取减少。此外,MOFs纳米粒子被摄取后,最初圆形的细胞形态被重塑成拉长的构象,这与巨噬细胞的活化状态一致。但是,在培育8 h后,细胞形态变化就不太明显了,如图5所示。上述结果表明,肝素涂覆可以降低细胞的识别和吸收能力,降低免疫应答与细胞内化,且能够在血液中循环较长的时间,从而使MOFs具有隐身的性能。另外,在体内使用这些包裹肝素的纳米粒子还有望产生较低的炎症反应。
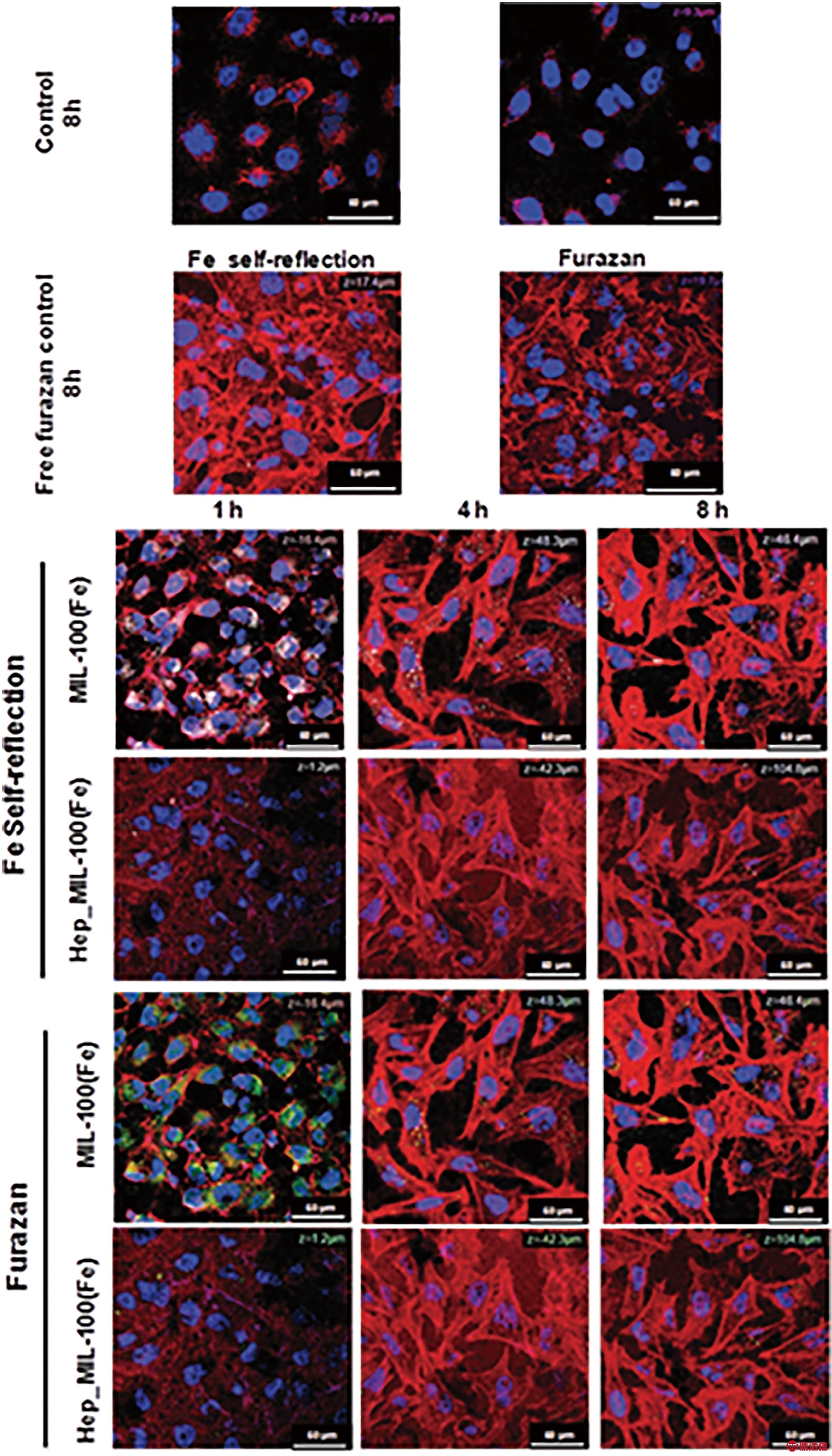
图5 通过铁自身反射信号观察到的含有MIL-100(Fe)和肝素包覆MIL-100(Fe)纳米粒的J774.A1细胞的共聚焦激光扫描显微照片[13]
Fig.5 Confocal microscopy images of J774.A1 cells containing uncoated and heparincoated MIL-100(Fe) nanoparticles observed by iron self-reflection signal[13]
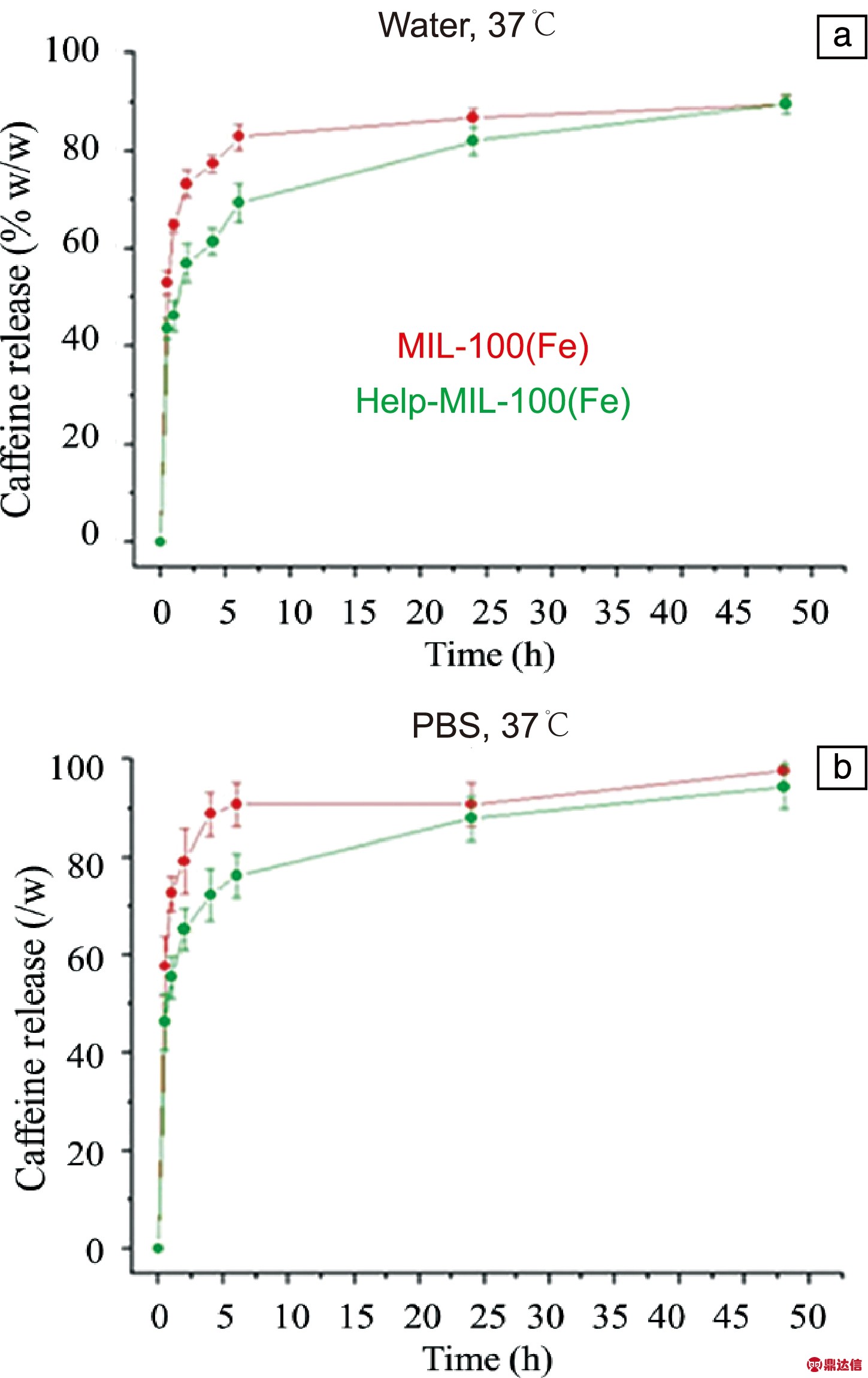
图4 37 ℃下在水(a)和磷酸盐缓冲液(b)中,MIL-100(Fe)(红)和肝素包覆MIL-100(Fe)(绿)纳米粒子中咖啡因的释放曲线[13]
Fig.4 Release curves of caffeine in water (a) and PBS (b) at 37 ℃ as a function of time for MIL-100(Fe) (red) and heparin coated MIL-100(Fe) nanoparticles (green) [13]
2.5 壳聚糖
壳聚糖(chitosan,CS)是甲壳素脱乙酰基产物,是一种天然的阳离子聚合物[21],作为药物载体可以防止胃肠道低pH值和酶引起的药物失活和降解,更重要的是,作为渗透促进剂可以调节肠道屏障,瞬间打开上皮细胞之间的紧密连接[22]。同时,CS通过与黏液链的非共价键相互作用(离子相互作用和氢键)增强对黏液的粘附行为[23],并保留在黏膜表面以供后续清除,是改善口服药物吸收的典型生物材料。Hidalgo等报道了采用CS修饰的MIL-100装载布洛芬(ibuprofen, Advil, AI),首次制备出了一种适合口服给药的纳米MOFs载体,既保留了MOFs的高孔性,又保留了MOFs的晶体结构。CS与MIL-100纳米粒子的主要相互作用发生在CS的羟基与MOFs的铁原子之间,CS涂层在一定程度上阻止Fe(III)的还原,并具有屏蔽作用,可以保护MOFs不被酶降解。此外,CS具有生物粘附性,适合AI在肠黏膜附近局部释放药物。由图6中Caco-2细胞的共聚焦显微照片可以看出,与未经包覆的MOFs相比,CS包裹MIL-100(Fe)纳米粒子的细胞吸收显著提高。随着时间的推移,CS包覆MOFs的细胞内化性得到了改善,仅孵育2.5 h后,肠道细胞内就有一定数量的CS-MIL-100(Fe)。上述结果表明,CS可以促进含AI的纳米MOFs载体通过黏膜屏障,提高AI的吸收率。表面改性还能提高纳米微粒在不同生理介质尤其是模拟体液中的化学稳定性和胶体稳定性,并使MOFs不易被免疫系统所识别。以上特点使CS修饰的MOFs适合用作口服给药载体[24]。
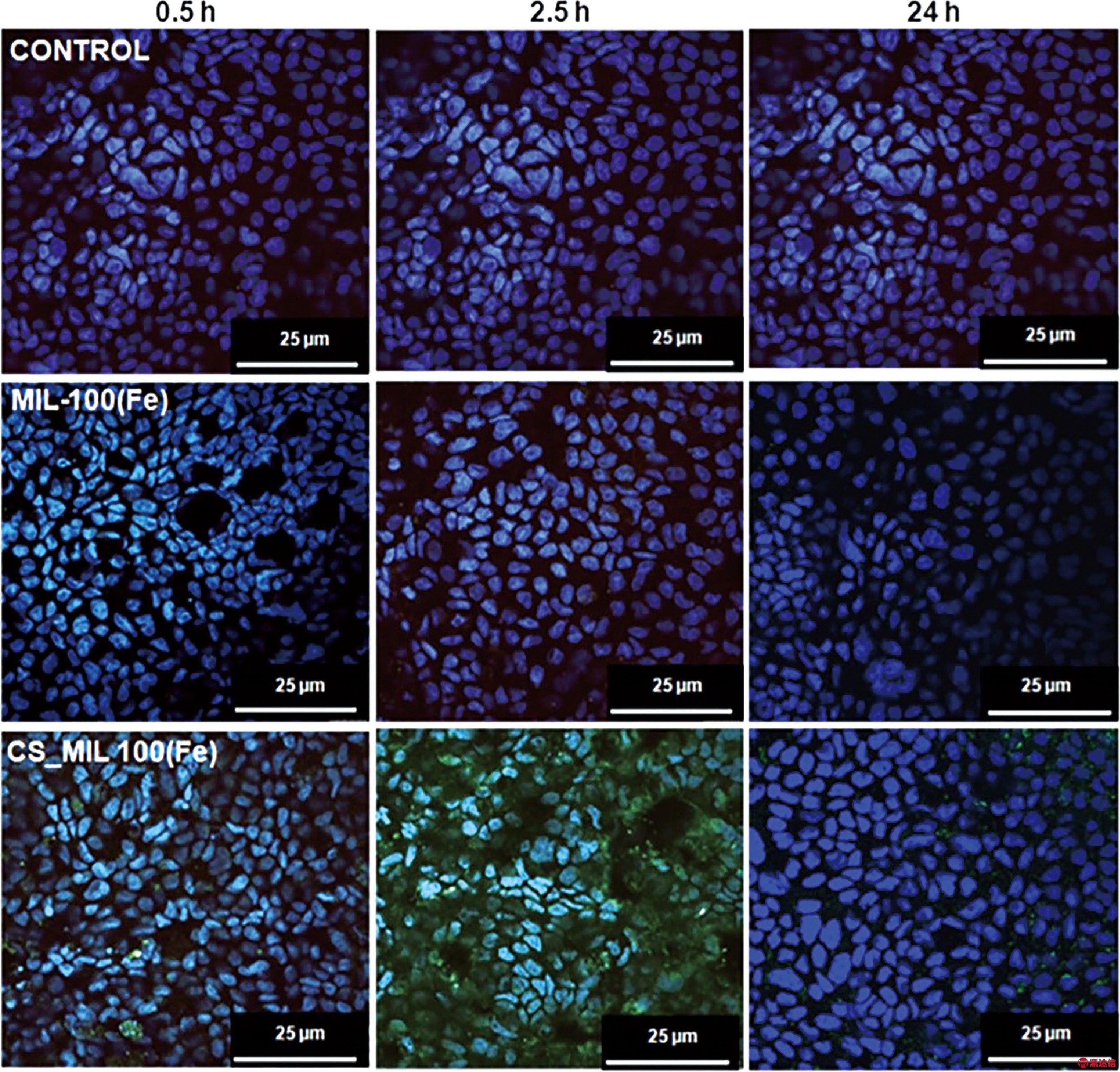
图6 用铁自反射信号(绿色)和DAPI染色(蓝色)观察未包覆和CS包覆的MIL-100(Fe)的Caco-2细胞的共聚焦激光扫描显微照片[24]
Fig.6 Confocal microscopy images of Caco-2 cells containing uncoated and CS-coated MIL-100(Fe) NPs observed by iron self-reflection signal (green channel) and the nucleus stained by DAPI (blue channel) [24]
CS分子结构中包含许多游离的羟基和氨基,在一定条件下,可以通过水解、交联、羧基化、烷化、酰化、氧化等方式对CS分子进行修饰改性[21]。例如,在CS结构中引入巯基,与肠黏液层糖蛋白半胱氨酸残基形成共价键[23],能够显著改善其生物粘附性,延长其肠道滞留时间,并抑制酪氨酸磷酸酶的活性,打开细胞间的紧密连接,提高药物对细胞膜的透过性。CS是MOFs作为口服给药载体理想的表面修饰材料。
2.6 靶向修饰材料
传统的给药方式对病变组织缺乏特异性,需要大量、频繁地给药,因而导致很多的副作用[25]。在MOFs表面修饰靶向材料,可以实现药物在特定部位的富集,还能在肿瘤部位快速释放化疗药物,从而延缓药物泄漏到健康的生理环境,提高治疗效果[26]。肿瘤部位的细胞表面存在过度表达的生物受体,能与相应的配体产生特异性识别,通过适当的方法可以将靶向修饰材料连接到MOFs表面,与药物分子一起构筑靶向DDSs[27],常见的靶向修饰材料有叶酸、DNA、甘草次酸等。
叶酸修饰的MOFs作为肿瘤靶向给药载体已经得到了广泛的研究[28-30],将叶酸与其他涂层材料共同修饰到MOFs表面可以起到双重功能化作用。Shi等报道了叶酸和PEGs共同修饰的MOFs,实现了延长循环和主动靶向给药[31]。Nejadshafiee等制备了包覆叶酸-壳聚糖偶联物的MOFs,用于肿瘤靶向给药[32]。Gao等将叶酸与荧光成像剂5-羧基荧光素共价连接到UiO-66-NH2表面,靶向肝癌细胞,并在体外显示出良好的荧光成像行为[33]。
研究表明[34],DNA修饰的MOFs表现出了更强的稳定性和细胞摄取能力。Ning等通过表面配位化学的方法将DNA固定在纳米MOFs表面,以靶向特定的癌细胞[35]。Chen等采用核酸基聚丙烯酰胺水凝胶修饰的MOFs装载阿霉素,该药物递送系统表面含有游离的核酸链,能与特定的细胞靶向配体相结合,对癌细胞的选择性和渗透性增强[36]。为克服卵巢癌细胞的耐药性,Lin等首次将顺铂前体药物——cis, cis, trans-[Pt(NH3)2Cl2(OEt)(OCOCH2CH2COOH)],包封到纳米MOFs的孔隙内,构建载药系统UiO-Cis,将小干扰素siRNA与纳米MOFs表面金属位点相结合(如图7所示),从而使耐药基因不能表达,同时也使耐药的卵巢癌细胞对顺铂的治疗重新变得敏感,以此来增强治疗效果[37]。
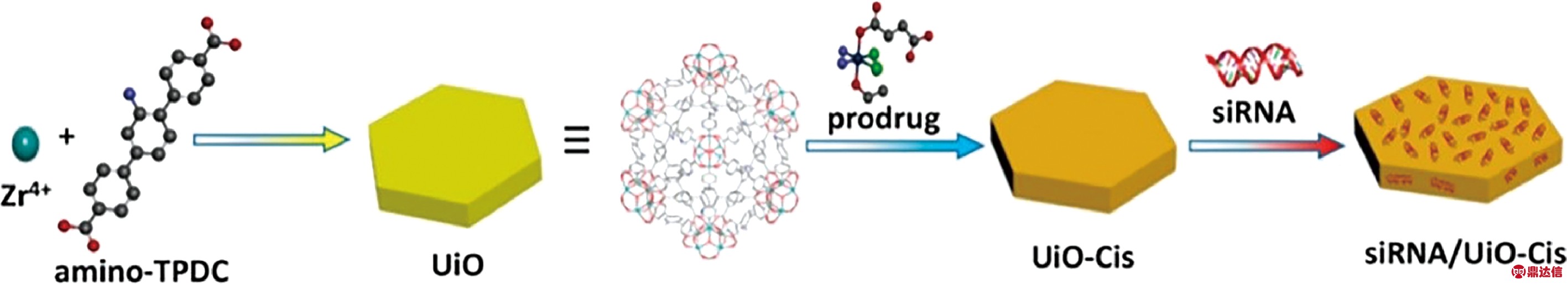
图7 siRNA/UiO-Cis合成及载药原理示意图[37]
Fig.7 Schematic presentation of siRNA/UiO-Cis synthesis and drug loading[37]
此外,肝细胞表面存在甘草次酸(glycyrrhetinic acid,GA)结合位点[38],甘草次酸修饰的DDSs可以将药物传递至肝脏部位从而发挥其特有的主动肝靶向效应,与抗癌药物形成的复合物也表现出明显的肝靶向特性[39]。
随着对抗癌机制研究的不断深入,MOFs表面修饰材料也在不断更新。肿瘤细胞还可能通过自噬来阻断凋亡通路,进而保护癌细胞不受抗肿瘤药物的侵袭。Chen等报道了纳米MOFs包覆自噬抑制剂用以克服肿瘤的耐药性,增强抗癌效果[40]。Filippousi等将载药MOFs包封在经修饰的聚(ε-己内酯)中,并用D-α-生育酚聚乙二醇琥珀酸酯聚合物基体进行包封,发现表面修饰的MOFs能够克服突释行为,提高缓释效果,具有更好的抗癌活性[41]。此外,有些研究选用磁性金属材料构建纳米颗粒,使其具有核磁共振成像的潜力[42, 43],同时再对其表面进行功能化修饰,以赋予多种治疗功能[44]。
3 结 语
自从Ferey等首次报道了MOFs在生物医学上的应用以来,大量对MOFs的开发工作都在进行中。MOFs具有超高的孔隙率、极大的比表面积、生物可降解性、结构可裁性和易功能化等特征,已得到越来越多的关注,但是其本身存在的一些固有缺陷,如较差的生物相容性、释药过程存在突释现象等,限制了它的开发和利用。另外,目前的研究大多集中在MOFs对药物的包载能力方面,而且多是以MOFs作为静脉注射载体,而作为药物口服载体的报道极少。对MOFs进行表面修饰可以克服一些不良特性,优化性能,扩展其在医药领域的应用。引入生物相容性好的成分对MOFs进行表面功能化,可以实现更长的血液循环,减少细胞内化,具有更好的细胞和组织特异性;利用生物粘附聚合物对MOFs表面进行修饰,可以延长其在肠道内的停留时间,显著改善药物的口服吸收;另外,在MOFs内部装载药物的同时,还可以用显影剂对其表面进行修饰,达到治疗和诊断同时进行的目的。随着MOFs表面修饰方法的不断完善及功能化修饰材料的不断更新,MOFs作为药物载体的潜力也逐渐被开发出来,在精准治疗、靶向给药、缓控释给药、口服给药、医学成像等方面应用前景广阔。



