摘 要构建了铅离子(Pb2+)功能核酸比色生物传感器, 用于可视化检测水中Pb2+。利用GR-5脱氧核酶对Pb2+特异性识别, 对底物链切割, 同时通过巧妙的核酸设计, 将GR-5脱氧核酶的切割产物与显色模板结合形成G-四链体, 其中显色模板主要包括与切割产物核酸的序列互补区、富含鸟嘌呤的G四链体形成区以及连接二者的间隔臂。在Pb2+存在时, GR-5脱氧核酶的底物链被识别、切割并释放, 此切割产物与显色模板结合, 并转化成G-四链体, 由于G-四链体在特定条件下具有类过氧化物酶活性, 可催化H2O2和3',3',5,5'-四甲基联苯胺(TMB)显色, 基于此构建了Pb2+功能核酸比色生物传感器。优化的实验条件为: GR-5脱氧核酶的底物链和酶链最优配比1∶1, 切割时间3 min, 显色模板浓度5 μmol/L, 最适TMB用量50 μL。本传感器检测Pb2+的线性范围为25 nmol/L~2.5 μmol/L, 线性关系为y=0.039x+0.3486(R=0.9904), 检出限为10.1 nmol/L (3σ), 用于自来水中Pb2+的检测, 加标回收率为98.2%~115.5%。本方法具有灵敏度高、特异性强、操作简单等优点, 具有良好的应用前景。
关键词铅离子; 功能核酸; 可视化; G-四链体; 生物传感器
1 引 言
铅离子(Pb2+)性质稳定、不易降解, 对人体神经系统、血液系统、心血管系统、骨骼系统等具有毒害作用[1], 低浓度即可对人的神经系统和血液系统造成不可逆的损伤。目前, Pb2+污染已经成为普遍存在且亟待解决的问题。我国生活饮用水卫生标准(GB5749-2006)中规定水中Pb2+限量值为0.01 mg/L(~50 nmol/L)[2]。因此, 建立准确、特异性强、简单快速的Pb2+检测方法, 对于环境监测和保障人类健康都具有重要意义。目前, 功能核酸的相关研究不断深入, 并已被广泛应用于生物传感和生物医疗领域。利用功能核酸特殊的催化性质可实现蛋白质、金属离子及小分子等的检测, 利用其靶向性质可实现肿瘤或癌细胞的给药和治疗等目的。目前发现的针对Pb2+的功能核酸主要包括GR-5脱氧核酶[3]和8-17[4]脱氧核酶, 这两种核酶都属于切割型脱氧核酶, 由酶链和底物链构成, 且底物链上的核糖核苷酸碱基为核酶的切割位点。相较于8-17脱氧核酶, GR-5脱氧核酶对Pb2+具有更高的特异性[5,6], 与不同的输出方法结合, 开发出了Pb2+特异性功能核酸生物传感器[7~10]。其中, 比色生物传感器因具有操作简单、价格低廉、易于观察等优点而受到广泛关注, 如Huang等[11]将Pb2+功能核酸结合杂交链式反应(HCR)和AuNPs, 开发了一种无标记、无酶的Pb2+比色生物传感器。
本研究以GR-5脱氧核酶作为Pb2+功能核酸生物传感器的特异性识别元件, 在Pb2+存在时, 底物链发生切割并释放, 游离出的切割产物可与人为设计的核酸序列(显色模板)结合。切割产物与显色模板结合后, 在聚合酶的作用下延伸, 延伸链替换显色模板上的富含G的核酸序列, 在适当环境下折叠成G-四链体, 形成具有类过氧化物酶活性的模拟酶, 并催化3',3',5,5'-四甲基联苯胺(TMB)显色, 实现Pb2+的可视化检测。
2 实验部分
2.1 仪器与试剂
S1000梯度PCR仪(美国Thermo公司); DYY-6C电泳仪(北京六一仪器厂); 蓝盾501凝胶成像仪(厦门百维信生物科技有限公司); D3024离心机(Scilogex公司); DK-98-1电热恒温水浴锅(天津市泰斯特仪器有限公司); VARIOSKAN FLASH多功能全波长酶标仪(赛默飞世尔科技(中国)有限公司)。
羟乙基哌嗪乙硫磺酸(HEPES)、三羟甲基氨基甲烷(Tris)、丙烯酰胺、甲叉双丙烯酰胺(Amresco公司); KCl、NaCl、MgCl2、EDTA-2Na、硫酸(北京化工厂); 尿素(西陇化工股份有限公司); Pb(Ac)2(国药集团化学试剂有限公司); 3',3',5,5'-四甲基联苯胺(TMB)、氯高铁血红素(Hemin)和其它金属盐(Sigma公司)。以上试剂均为分析纯。SYBR Gold核酸染料(英维捷基(上海)贸易有限公司); 30% H2O2(北京蓝戈有限公司); Bst 3.0 DNAPolymerase(NEB公司); 脱氧核糖核苷酸的混合物(dNTPs,宝生物工程(大连)有限公司)。实验用水为超纯去离子水。
所用DNA核酸序列由生工生物工程(上海)股份有限公司合成, 序列见表1。
表1 DNA核酸序列
Table 1 DNA sequences used in this work

2.2 实验方法
2.2.1 Pb2+切割反应 取1 μmol/L GR-5酶链和1 μmol/L GR-5底物链于缓冲液(50 mmol/L HEPES、 50 mmol/L NaCl、 5 mmol/L MgCl2, pH=7.6)中, 混匀, 离心, 95℃孵育15 min, 然后缓慢降至室温, 形成GR-5脱氧核酶。向反应体系中加入200 μmol/L Pb2+, 25℃下切割, 加入2 mol/L EDTA-2Na终止反应。样品于4℃保存, 或通过变性聚丙烯酰胺凝胶电泳(dPAGE)进行验证。
2.2.2 显色反应 取10 μL上述样品加入到含有5 μmol/L显色模板、0.06 U/μL Bst 3.0 DNA Polymerase、0.25 mmol/L dNTPs、1 × Thermo Pol的体系中, 体系总体积50 μL。体系在55℃孵育反应10 min后, 在95℃孵育10 min使酶失活。 取10 μL上述体系和10 μL 20 μmol/L Hemin溶液, 加入到80 μL DNAzyme酶活性提升缓冲液(10 mmol/L NaH2PO4-Na2HPO4、100 mmol/L KCl、2 mmol/L MgCl2, 0.003% (V/V) Triton X-100、pH=8.4), 37℃孵育30 min, 加入50 μL TMB显色10 min, 加50 μL 2 mol/L H2SO4终止反应, 利用酶标仪测定450 nm处的吸光值。
3 结果与讨论
3.1 实验原理
本研究利用GR-5脱氧核酶作为Pb2+功能核酸生物传感器的特异性识别部分, GR-5脱氧核酶由酶链和底物链构成, 其中底物链包含一个核糖核苷酸为脱氧核酶的切割位点, 在Pb2+存在时底物链断裂, 并从酶链上释放游离出切割产物。为了实现Pb2+的裸眼可视检测, 本研究引入了一个可将GR-5脱氧核酶的切割产物转化成富G序列且可形成G-四链体的显色模板。此显色模板主要由三部分构成: 可与切割产物互补配对的核酸序列、富含鸟嘌呤的核酸序列、链接以上两部分的间隔臂聚六乙二醇(Spacer 18)。切割产物与显色模板结合后, 在BST 3.0 DNA polymerase的催化下延伸, 延伸产物链置换掉显色模板上的富G序列, 又由于间隔臂Spacer 18具有抑制BST 3.0 DNA polymerase延伸的作用, 所以置换掉的富G序列以单链形式存在。在合适条件下, 单链的富G序列可折叠形成G-四链体, 结合Hemin后, 形成类过氧化物酶, 可催化H2O2和TMB显色, 进而实现Pb2+的可视化检测。由于BST 3.0 DNA polymerase的最适温度为55℃~60℃, 所以需考虑切割产物与显色模板结合后在此温度下是否稳定存在, 因此在GR-5脱氧核酶的底物上人为增加了6个胞嘧啶(C), 以增加结合的稳定性。传感器的原理图如图1所示。
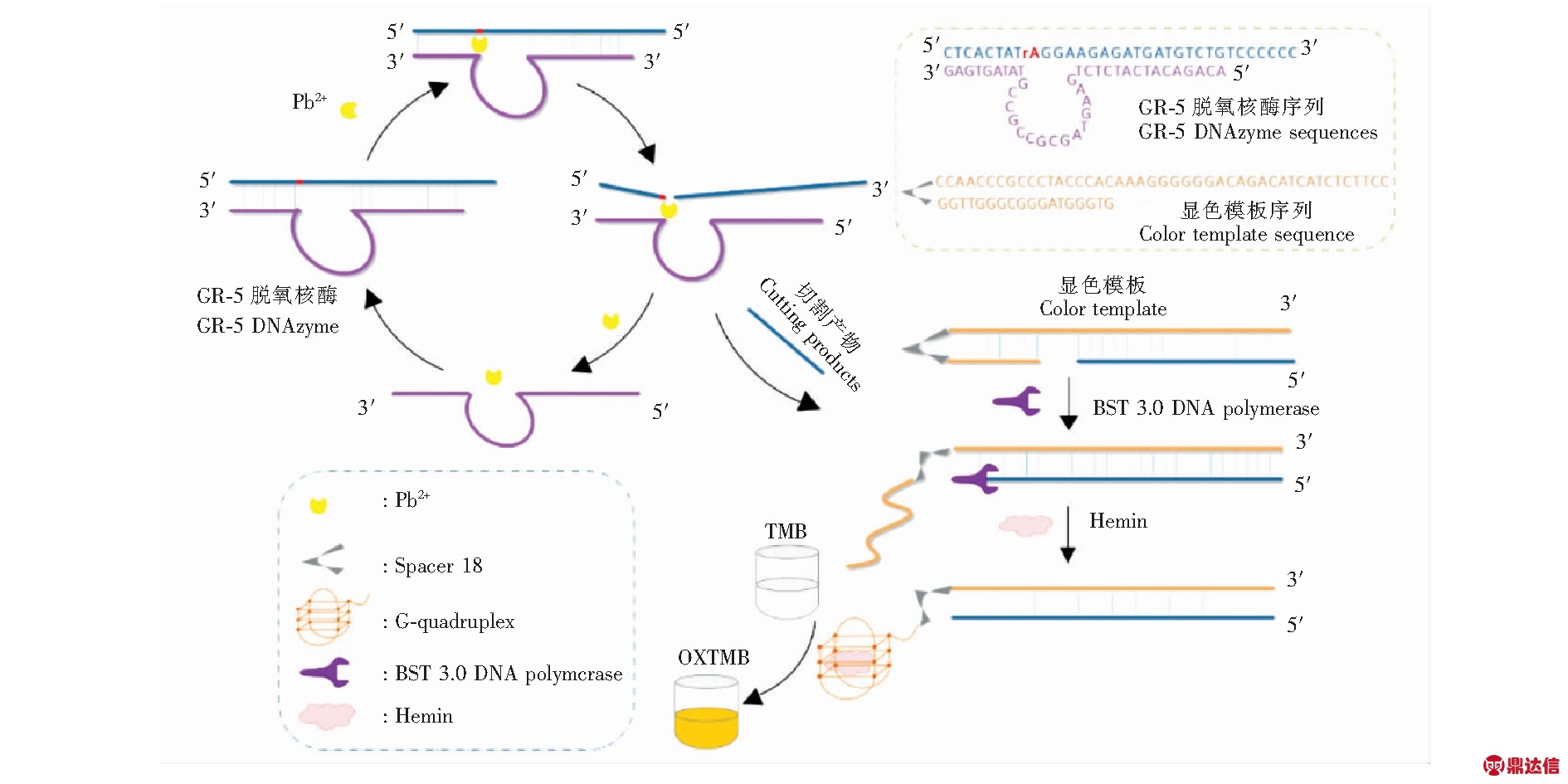
图1 Pb2+功能核酸生物传感器原理图
Fig.1 Schematic illustration of functional nucleic acid biosensor for detection of Pb2+
TMB, 3,3',5,5'-tetramethylbenzidine; OXTMB, oxidized TMB.
3.2 实验可行性分析
为了验证实验原理的可行性, 首先验证GR-5脱氧核酶对Pb2+的特异性识别能力。由于dPAGE是对单链核酸长度最直接的验证方法, 所以本研究采用该方法验证GR-5脱氧核酶底物链在切割前后的核酸链长度变化。在图2A电泳图中, 泳道1为1 μmol/L GR-5-sub, 泳道2为1 μmol/L GR-5-enzyme。未加入Pb2+的阴性对照组未发生切割, 而加入Pb2+的实验组产生了明显的切割条带, 表明GR-5脱氧核酶可特异性识别Pb2+, 并具有较好的切割效果。
取20 nmol/L Pb2+切割产物, 按照2.2.2节中显色反应体系进行后续实验, 结果如图2B所示。在加入Pb2+后, 体系的光谱图中出现明显的吸收峰, 并且具有明显的颜色变化, 验证了显色模板设计方案可行。
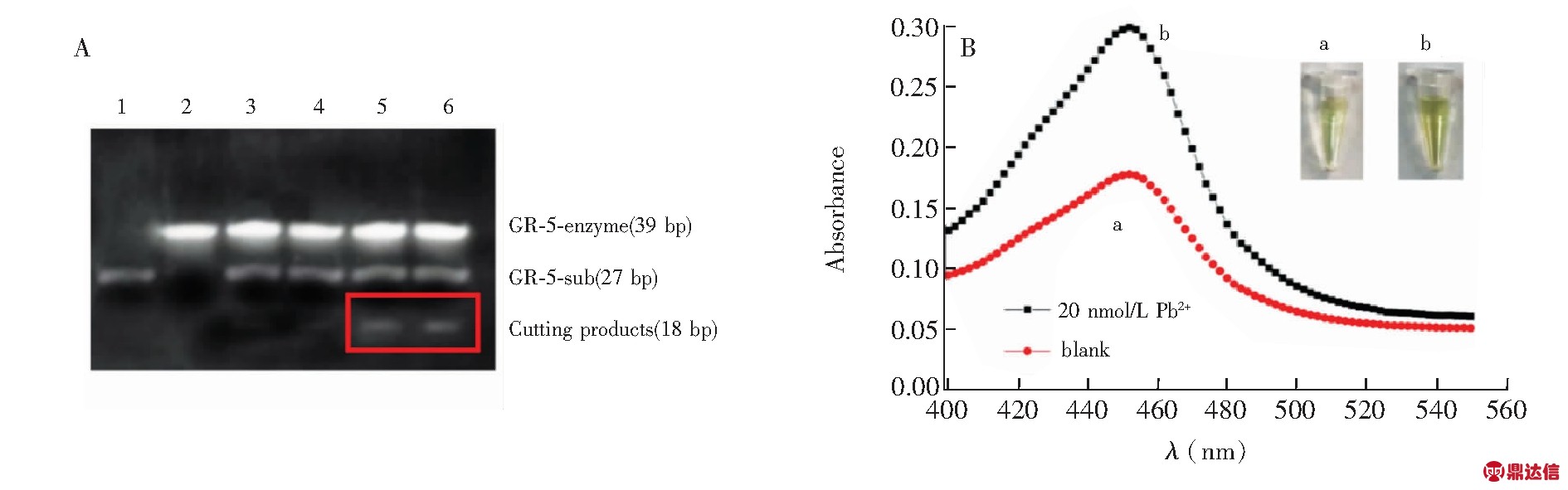
图2 可行性验证实验结果: (A)切割反应体系验证, Lane 1: 1 μmol/L GR-5-sub; Lane 2: 1 μmol/L GR-5-enzyme; Lane 3,4: 1 μmol/L GR-5-sub+1 μmol/L GR-5-enzyme; Line 5,6: 1 μmol/L GR-5 enzyme+1 μmol/L GR-5 sub+200 μmol/L Pb2+, 3 min切割; B: 显色反应体系验证, 曲线a是无Pb2+加入的切割体系加入到显色反应体系的吸收光谱图; 曲线b是20 nmol/L的Pb2+切割产物加入到显色反应体系中吸收光谱图。插图为对应的实际样品照片
Fig.2 Feasibility testing results of the biosensing system. (A) Cutting reaction system verification by denaturing polyacrylamide gel electrophoresis (Lane 1, 1 μmol/L GR-5-sub; Lane 2, 1 μmol/L GR-5-enzyme; Lane 3 and 4, 1 μmol/L GR-5-sub+1 μmol/L GR-5-enzyme; Line 5 and 6, 1 μmol/L GR-5 enzyme+1 μmol/L GR-5 sub+200 μmol/L Pb2+, for 3 min); (B) Color reaction system verification, curve a is absorption spectrum of the color reaction system without the addition of Pb2+cleavage system, curve b is absorption spectrum of 20 nmol/L Pb2+ cleavage products added to the color reaction system. Insets are corresponding photos
3.3 Pb2+切割反应体系优化
优化了Pb2+切割反应体系, 包括Pb2+脱氧核酶的酶链和底物链比例及Pb2+脱氧核酶的切割时间。
Pb2+脱氧核酶的酶链和底物链是两条寡核苷酸链在高温变性、低温退火的条件下杂交形成的, 由于核酸链之间存在密度效应和竞争效应, 导致Pb2+脱氧核酶不能完全形成如原理图中的二级结构, 通过调节酶链和底物链配比, 以形成最高浓度的Pb2+脱氧核酶。固定底物链浓度为1 μmol/L, 酶链浓度分别选取0.5、1、3、6、和10 μmol/L进行实验, 测量了不同配比时吸光值(图3A), 确定最优配比为1∶1。
生物传感器的检测响应时间是传感器实用性的重要指标。采用dPAGE的方法直接观察是否生成切割产物, 并采用Nano drop UV仪测量反应体系在260 nm下的吸光值, 间接反映体系中单链核苷酸的生成。如图3B所示, 泳道4的切割产物无明显增加, 可基本确定GR-5脱氧核酶的切割在3 min已经完成; 在图3C中, 3 min时A260 nm达到最大, 表明体系中单链核酸最多, 即切割产物最多, 因此, 选择Pb2+切割脱氧核酶GR-5的切割时间为3min。
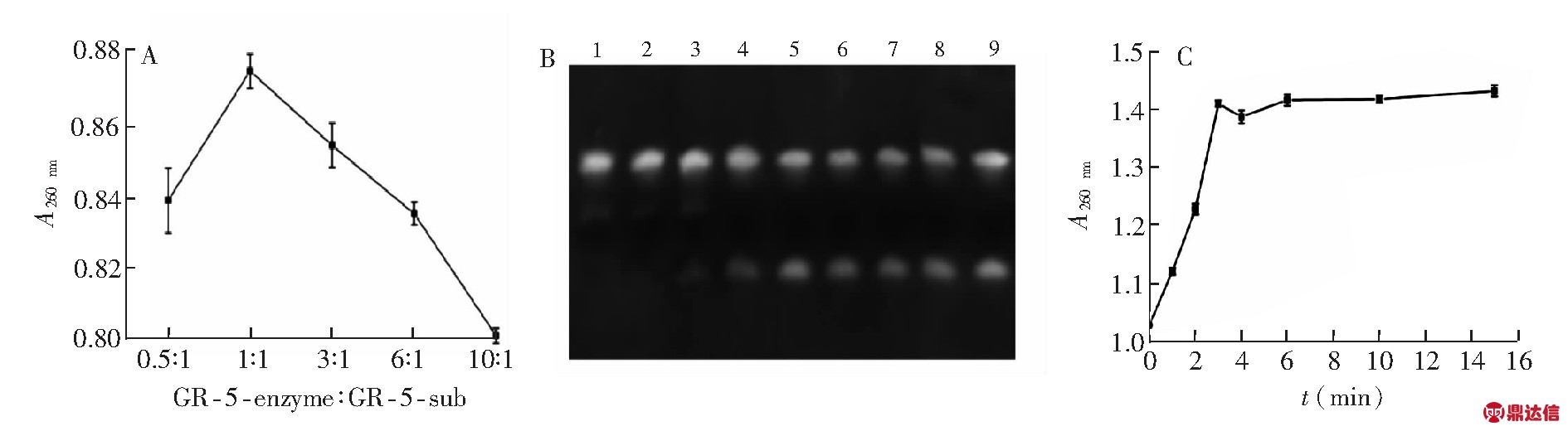
图3 Pb2+切割反应体系条件的优化: (A) 底物链和酶链配比优化; (B)切割时间优化的电泳检测结果(Lane 1: 1 μmol/L GR-5-sub+1 μmol/L GR-5-enzyme; Lane 2: 1 μmol/L GR-5 enzyme+1 μmol/L GR-5 sub + 200 μmol/L Pb2+, 1 min切割; Lane 3: 2 min切割; Lane 4: 3 min切割; Lane 5: 4 min切割; Lane 6: 6 min切割; Lane 7: 9 min切割; Lane 8: 15 min切割; Lane 9: 30 min切割); (C) 不同切割时间下体系的A260 nm值
Fig.3 Optimization of Pb2+ cutting reaction system.(A) optimization of the ratio of GR-5-sub versus GR-5 enzyme; (B) Optimization of enzymatic cleavage time by electrophoresis ( Lane 1: 1 μmol/L GR-5-sub+1 μmol/L GR-5-enzyme; Lane 2: 1 μmol/L GR-5 enzyme+1 μmol/L GR-5 sub + 200 μmol/L Pb2+, reacting for 1 min; Lane 3: reacting for 2 min; Lane 4: reacting for 3 min; Lane 5: reacting for 4 min; Lane 6: reacting for 6 min; Lane 7: reacting for 9 min; Lane 8: reacting for 15 min; Lane 9: reacting for 30 min); (C) A260 nm of the biosensing system at different cleavage time
3.4 显色反应优化
显色反应体系是Pb2+功能核酸比色生物传感器的信号输出部分, 对于传感器的检测灵敏度具有至关重要的作用。对显色模板的浓度和TMB用量进行了优化。实验结果如图4所示, 随着显色模板浓度的增加, 体系在450 nm处的吸光值逐渐增加(图4A), 显色模板的最优浓度为5 μmol/L; 显色反应中TMB的用量为50 μL时, 显色强度最大(图4B), 因此选择TMB的用量为50 μL。
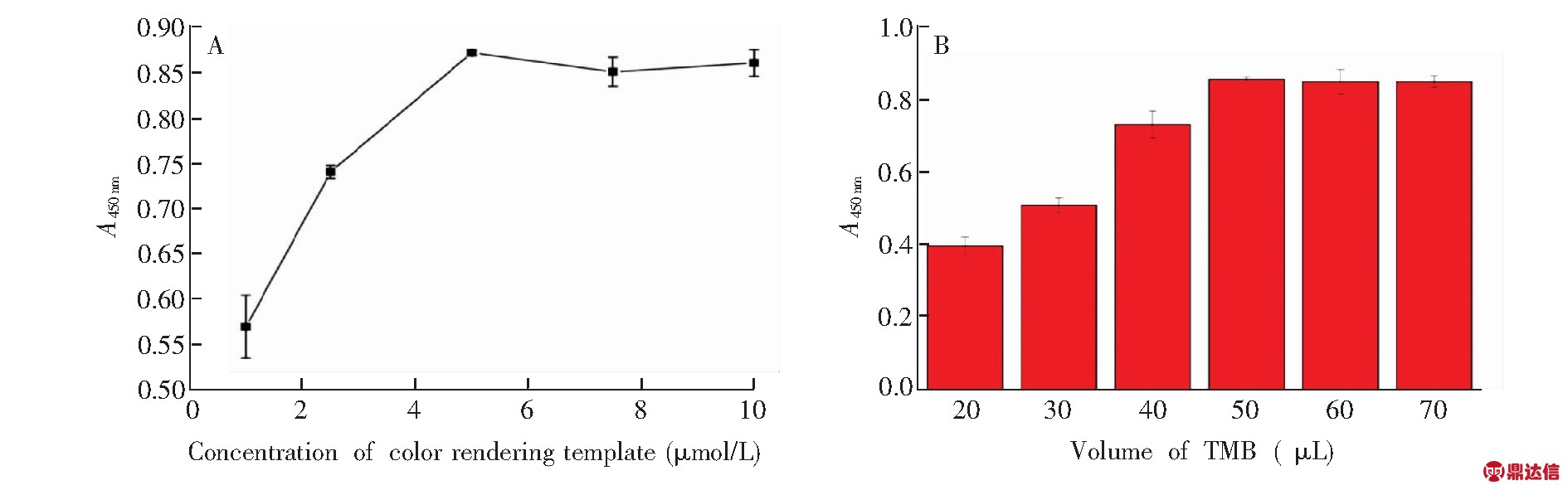
图4 显色反应体系优化: (A)显色模板浓度的影响; (B )TMB用量的影响
Fig.4 Optimization of color reaction system: (A) Effect of color rendering template concentration; (B) Effect of TMB amount
3.5 传感器的检测性能
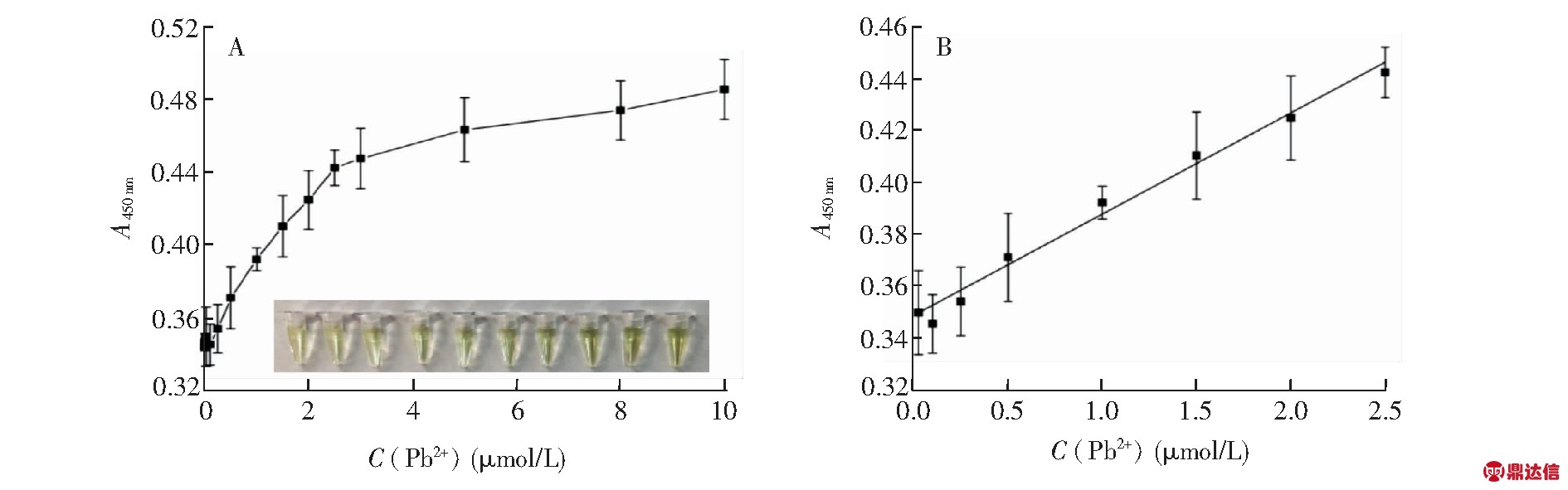
图5 (A)不同浓度Pb2+下传感器在450 m处的响应值; (B)检测Pb2+的校正曲线
Fig.5 (A) Response of the biosensor at 450 nm toward different concentrations of Pb2+; (B) Calibration curve of the biosensor for detection of Pb2+
在最优条件下, 对不同浓度的Pb2+分别进行了检测, 结果如图5所。随着Pb2+浓度增加, 体系在450 nm处的吸光值逐渐增大, 并趋于稳定。在25 nmol/L~2.5 μmol/L浓度范围内, Pb2+浓度与A450 nm具有良好的线性关系, 线性方程为y=0.039x+0.3486, r=0.9904, 检出限为10.1 nmol/L(3σ), 可满足国标对自来水中的Pb2+限量要求(50 nmol/L)[2], 表明此生物传感器具有良好的灵敏度。
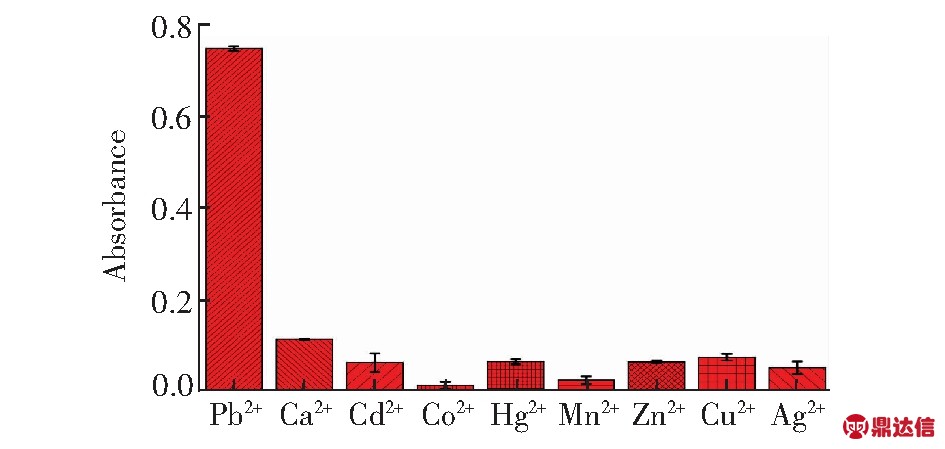
图6 传感器的特异性分析
Fig.6 Specificity of the proposed sensor towards Pb2+. Pb2+: 100 μmol/L; Ca2+, Cd2+, Co2+, Hg2+, Mn2+, Zn2+, Cu2+, Ag+: 10 mmol/L
3.6 传感器的特异性分析
考察了此传感器检测10 mmol/L的Ca2+、Cd2+、Co2+、Hg2+、Mn2+、Zn2+、Cu2+、Ag+以及100 μmol/L Pb2+的情况。如图6所示, 此生物传感器仅对Pb2+有明显的响应, 而对于其它几种金属离子基本无明显响应, 表明此传感器对Pb2+具有高选择性。
3.7 实际样品分析
为了验证本生物传感器的实用性,对自来水样品进行了检测, 结果均未检出Pb2+。在自来水样品中分别添加50、100 和200 nmol/L Pb2+, 采用本方法进行测定, 结果见表2, 加标回收率在98.2%~115.5%之间, 表明本传感器具有良好的实用性。
表2 自来水中Pb2+加标回收实验结果
Table 2 Recovery of Pb2+ in tap water sample

4 结 论
构建了检测Pb2+的功能核酸生物传感器。通过Pb2+特异性核酶GR-5实现Pb2+的特异性识别, 通过显色模板将脱氧核酶的切割产物转化成具有类过氧化物酶活性的G四链体, 实现Pb2+的可视化检测。本传感器操作简单方便、灵敏度高、特异性好、检测速度快, 对实际样品具有良好的检测性能。



