摘 要 通过简单的热解过程成功制备了结构优化的多孔石墨烯(PG),并用于构建复杂体系中毛蕊异黄酮(CYS)痕量分析的电化学传感器。采用拉曼光谱法、傅里叶红外光谱分析法及扫描电子显微镜对制备过程进行了表征。循环伏安法(CV)和交流阻抗法(EIS)研究了PG修饰的玻碳电极(PG@GCE)的电化学行为,结果表明,PG有效增加了修饰电极的有效比表面积和电极表面的电子传递速率,中药电活性成分CYS在PG@GCE表面具有良好的电化学响应。在优化的条件下,采用差分脉冲伏安法(DPV)对CYS进行分析,CYS在1.8×10 7~4.4×10
7~4.4×10 5 mol/L浓度范围内具有良好的线性关系,检出限为5.8×10
5 mol/L浓度范围内具有良好的线性关系,检出限为5.8×10 8 mol/L(S/N=3)。将此传感器用于中药黄芪、红芪的提取物及血浆样品中CYS的分析时,呈现良好的分析性能。本研究为中药黄芪和红芪中指标性成分的快速分析及生物样品中CYS的痕量分析提供了一种新颖的分析手段,也进一步深化了PG在药物分析领域的应用。
8 mol/L(S/N=3)。将此传感器用于中药黄芪、红芪的提取物及血浆样品中CYS的分析时,呈现良好的分析性能。本研究为中药黄芪和红芪中指标性成分的快速分析及生物样品中CYS的痕量分析提供了一种新颖的分析手段,也进一步深化了PG在药物分析领域的应用。
关键词 多孔石墨烯;毛蕊异黄酮;电化学传感器;痕量分析
1 引 言
毛蕊异黄酮(Calycosin,CYS)作为中国药典规定的用于中药材黄芪和红芪质量标准评价的指标性成分之一,在机体内常与细胞膜上的ER受体结合,能够有效调节MAPK信号通路[1],在肿瘤的防治[2]、炎症的消退[3]、糖尿病认知障碍[4]和心血管疾病的改善[5]等方面具有重要作用。药材和制剂中以及机体内最低血药浓度时,CYS含量的快速、实时、准确的分析,对于以CYS为评价指标的药材、制剂的质量控制和CYS发挥药效防治相关疾病具有极为重要的意义。
CYS作为典型的异黄酮类化合物,是以3-苯基苯并吡喃酮为母核,7,3′位连接羟基(![]() ),4′位连接甲氧基(
),4′位连接甲氧基(![]() )而成。由于连接在3位的B环与
)而成。由于连接在3位的B环与![]() 双键、4位羰基及A环形成了p-π共轭体系,有利于电子离域,致使3′位羟基(
双键、4位羰基及A环形成了p-π共轭体系,有利于电子离域,致使3′位羟基(![]() )具有较高的活性[6],极容易发生氧化还原反应。因此,可以通过电化学方法检测3′位羟基发生氧化还原反应的电信号,进而实现样品中CYS含量的快速分析。然而,目前CYS的分析方法多采用色谱法[7~9]和色谱-质谱联用[10,11]等技术,这些方法多需复杂的样品前处理和繁琐耗时的操作,不便于复杂样品中CYS的便捷高效分析。电化学分析技术因其具有无需复杂的样品前处理、操作简便、灵敏度高、分析速度快等特点[12~14],已在水质监测、食品安全、药品质量评价等领域受到研究者的关注[15~18]。目前鲜有采用电化学方法用于CYS分析的报道。
)具有较高的活性[6],极容易发生氧化还原反应。因此,可以通过电化学方法检测3′位羟基发生氧化还原反应的电信号,进而实现样品中CYS含量的快速分析。然而,目前CYS的分析方法多采用色谱法[7~9]和色谱-质谱联用[10,11]等技术,这些方法多需复杂的样品前处理和繁琐耗时的操作,不便于复杂样品中CYS的便捷高效分析。电化学分析技术因其具有无需复杂的样品前处理、操作简便、灵敏度高、分析速度快等特点[12~14],已在水质监测、食品安全、药品质量评价等领域受到研究者的关注[15~18]。目前鲜有采用电化学方法用于CYS分析的报道。
多孔石墨烯(Porous graphene,PG)为具有中空网络结构的石墨烯衍生物,既保留了单层石墨烯优良的导电性能,又克服了石墨烯自身过强的π-π堆叠而导致的堆积和自聚集的缺点[19,20],其显著增大的比表面积能够使待测物最大程度暴露,而连续和互连的石墨烯孔隙则有利于电荷载体的迅速移动[20,21],有利于改善和提高传感器性能[22~24]。Yang等[25]制备了一种空心结构的CuCO2O4多面体/PG复合物,构建了用于葡萄糖灵敏测定的电化学传感器,结果表明,葡萄糖在0.5~3354 μmol/L范围内具有良好的线性关系,检出限为0.5 μmol/L(S/N=3)。Dong等[26]采用化学气相沉积的方法将PG附着在Ni表面,构建了用于多巴胺分析的电化学传感器,该方法具有较低的检出限(25 nmol/L)和较高的灵敏度,且可以很好地区分尿酸的干扰。
目前,尚未有以PG为电极修饰材料构建的用于复杂体系中中药电活性成分灵敏分析的研究报道。基于此,本研究制备了PG,以其为电极修饰材料,构建了用于CYS痕量分析的电化学传感器(图1)。结果表明,此传感器用于中药提取物和血浆样品中CYS分析时,呈现出较低的检出限、较宽的线性范围及较好的选择性。

图1 多孔石墨烯(PG)的制备及用于CYS测定的PG@GCE传感器构建示意图
Fig.1 Schematic diagram of synthesis of porous graphene (PG) and fabrication process of PG@GCE for determination of calycosin (CYS)
2 实验部分
2.1 仪器与试剂
CHI 6041E型电化学工作站(上海辰华仪器有限公司),采用三电极系统:以修饰玻碳电极(GCE,d=3 mm)为工作电极,饱和甘汞电极(SCE)为参比电极,铂丝电极为辅助电极;JSM-6701F冷场发射型扫描电镜(日本电子光学公司);Finder One 微区激光拉曼光谱仪(北京卓立汉光仪器有限公司);Nicolet IS5红外光谱仪(美国Thermo公司)。毛蕊异黄酮(CYS,宝鸡市辰光生物科技有限公司)。所用试剂均为分析纯。
2.2 实验方法
2.2.1 PG的制备 采用热解法制备PG[27]:首先将2 g金属钠(Na)和5 mL乙醇(C2H5OH)以摩尔比1∶1混合,在不锈钢反应器(50 mL)中220℃加热48 h,冷却至室温,得到白色产物。将得到的白色产物用去离子水裂解,白色产物变成黑色,即为PG。用去离子水反复洗涤数次,最后将其冷冻干燥,获得最终产物PG,用异丙醇溶解,配制成1 mg/mL的分散液,备用。
2.2.2 修饰电极的制备 将玻碳电极用0.3 μm和0.05 μm的氧化铝粉依次打磨抛光,蒸馏水冲洗,随后将处理后的电极依次于甲醇和蒸馏水中超声清洗1 min,自然晾干,备用。采用滴涂法将5 μL 1 mg/mL的PG分散液修饰在玻碳电极表面,自然晾干,记为PG@GCE。
2.2.3 电化学表征 在含有5 mmol/L [Fe(CN)6]3-/4-和0.1 mol/L KCl 溶液中,用循环伏安法(Cyclic voltammetric,CV)和交流阻抗法(Elecctrochemical impedance spectroscopy,EIS)对不同修饰电极进行表征。CV的测量条件为:电位范围为-0.2~0.8 V,扫速为100 mV/s。EIS测量条件为:振幅为0.005 V,电压为0.2 V,频率范围为10-1~105 Hz。
2.2.4 样品的制备 (1)黄芪、红芪样品溶液的预处理 称取4 g黄芪粉末(过4号筛),置于250 mL圆底烧瓶中,加入40 mL甲醇,于80℃水浴回流提取两次,每次1 h,过滤,合并两次提取液并浓缩至10 mL。 待测红芪样品溶液处理方法同上。(2)生物样品溶液的预处理 小鼠动脉取血4 mL于肝素抗凝管中,4℃下放置,备用。取2 mL 0.204 mg/mL CYS甲醇溶液于EP管中,加入抗凝血浆2 mL,振摇混合,将混合液于4000 r/min离心15 min,取上清液,即得样品溶液,待测。
3 结果与讨论
3.1 材料的表征
如图2A所示,修饰在电极表面的氧化石墨烯(Graphene oxide,GO)堆叠形成一种相互交错的褶皱结构。图2B是修饰在电极表面的PG的整体形貌,图2C是倍数放大的内部呈现中空网络结构的PG形貌,大量的孔道作为PG结构的支撑[28],有效地防止了石墨烯纳米片层聚集,大大增加了PG的比表面积,也为小分子电活性化合物的富集、生物分子的吸附等提供了较多的活性位点。此外,PG中空的网络结构为电荷载体在其连续和互连的孔径中的迅速移动提供了可能,有利于电化学传感器灵敏度的提高[27]。
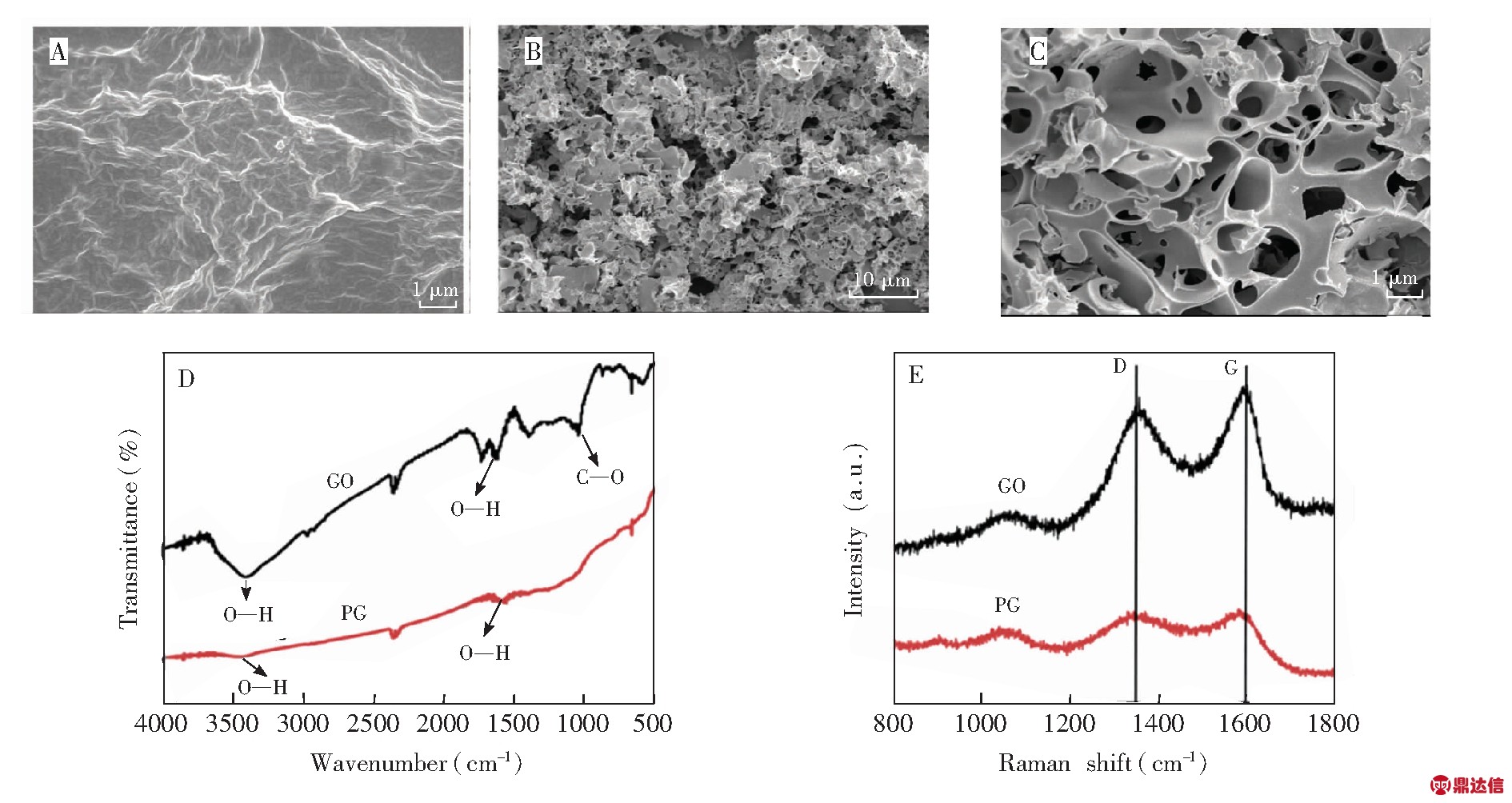
图2 GO(A)和PG(B、C)的SEM图;(D)GO和PG的红外光谱图;(E) GO和PG的拉曼光谱图
Fig.2 Scanning electron microscopy (SEM) images of graphene oxide (GO) (A) and porous graphene (PG) (B,C);(D) Fourier transform infrared (FT-IR) spectra of GO and PG;(E) Raman spectra of GO and PG
采用红外光谱对GO和PG进行了表征。由图2D可见,PG(曲线b)在3000~3700 cm-1处的红外吸收较GO(a)明显减小,这是由于PG表面所带的含氧官能团较少所致。此外,GO在1400和1048 cm-1处分别对应![]() 键和
键和![]() 键的特征吸收[29],而PG在此处的特征吸收峰则明显减弱,甚至消失,表明本研究所制备的PG具有较低的氧化程度。
键的特征吸收[29],而PG在此处的特征吸收峰则明显减弱,甚至消失,表明本研究所制备的PG具有较低的氧化程度。
由拉曼光谱(图2E)可见,GO(曲线a)和PG(曲线b)在1346和1580 cm-1处有两个明显的峰,分别对应D带和G带。G带为E2g光学模式的一阶拉曼散射,对应于有序的sp2结构;D带为布里渊区K点的A1g声子模式,对应于无序程度和边缘的局部缺陷,D峰与G峰的强度比(r=ID/IG)可用于衡量物质的缺陷和混乱程度,D带是由sp2杂化转变为sp3引起的,这一变化会影响有序性[30]。通过计算可得GO 和PG 的D峰与G峰的强度比rGO=0.780,rPG=1.05,可知本研究制备的PG具有相对较多的缺陷结构,这与PG具有的中空网络结构密切相关,此结果与SEM表征结果相一致。
3.2 电化学传感器有效比表面积的计算
以K3[Fe(CN)6]为探针分子,采用计时库仑法对3种电极(GCE、GO/GCE和PG@GCE)的电化学有效表面积进行了计算,计时库仑法的电化学实验参数设置为:起始电位0.5 V,终止电位-0.2 V,脉冲宽度 0.25 s,采样间隔2.5×10-4 s。根据Anson方程[31]:
(1)
式中,c表示电解液中底物的浓度,D为扩散系数(0.5 mmol/L K3[Fe(CN)6]在1.0 mol/L KCl 溶液中的扩散系数为1.39×10-4 cm2/s),n为电子转移数,Qdl为双电层电量,Qads为感应电荷,A为电极的电化学有效表面积,F为法拉第常数。由图3B可见,Q与t1/2呈良好的线性关系,根据线性方程的斜率可以计算出GCE、GO/GCE和PG@GCE的电化学有效表面积分别为0.16、0.23和0.47 cm2。结果表明,玻碳电极经PG修饰后,电化学有效面积显著增加,有利于CYS在电极表面的大量富集,进而增强了CYS的电化学响应信号。
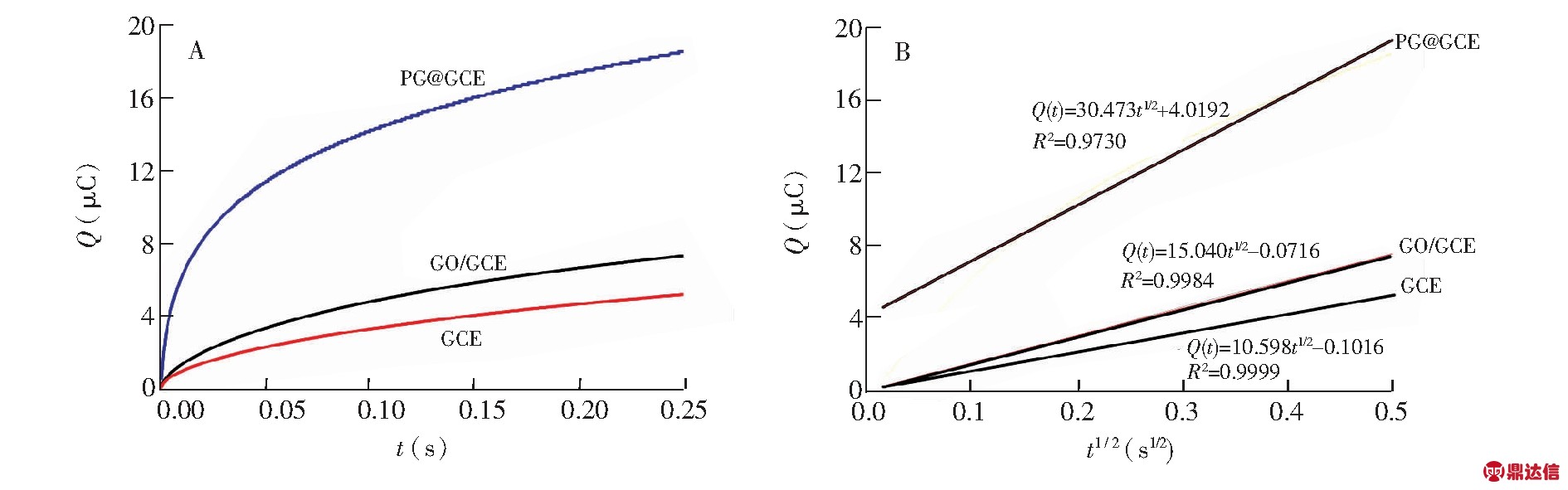
图3 (A)3种电极在0.5 mmol/L K3[Fe(CN)6]/1.0 mol/L KCl溶液中的Q-t曲线;(B)3种电极的Q-t1/2线性关系图
Fig.3 (A) Q-t curves of three electrodes in 0.5 mmol/L K3[Fe(CN)6]/1.0 mol/L KCl solution;(B) Q-t1/2 linear plot
3.3 PG@GCE修饰电极的电化学表征
采用循环伏安法和交流阻抗法对基于PG构建的电化学传感器进行了表征。由图4A可知,当PG修饰在玻碳电极表面(曲线b)后,峰电流明显较裸玻碳电极(曲线a)增大,这是由于PG中空的网络结构和优良的导电性,增加了电极表面电子的转移速率。交流阻抗法的表征结果(图4B)进一步表明,PG修饰在裸玻碳电极(曲线b)表面后,极大地减小了电子传递电阻(Ret),有效促进了电极表面电子的快速转移。
3.4 CYS在传感器上的电化学行为
考察了0.1 mol/L醋酸盐缓冲液(ABS)、磷酸盐缓冲液(PBS)、柠檬酸盐缓冲液(CPBS)为支持电解液中传感器的电化学响应。实验结果表明,构建的传感器在0.1 mol/L醋酸盐缓冲液中的基线平稳且响应最灵敏。因此,选择醋酸盐缓冲液作为支持电解液。图4C为GCE(曲线a,b)和PG@GCE(曲线c,d)在不含有和含有2.8×10-5 mol/L CYS的0.1 mol/L pH 7.0的醋酸缓冲液中的循环伏安图。PG@GCE在空白缓冲体系中没有氧化还原峰。图 4D中CYS在GCE(曲线b)上出现一对较弱的氧化还原峰,而在PG@GCE(图 4C曲线d)上呈现一对明显的接近对称的氧化还原峰,峰电位分别为Epa=0.230 V和Epc=0.412 V,-Ep=182 mV,表明CYS在PG@GCE上具有良好的电化学响应,明显增强的伏安响应是由于PG大的比表面积和可显著促进电极表面电子快速传递的性质。
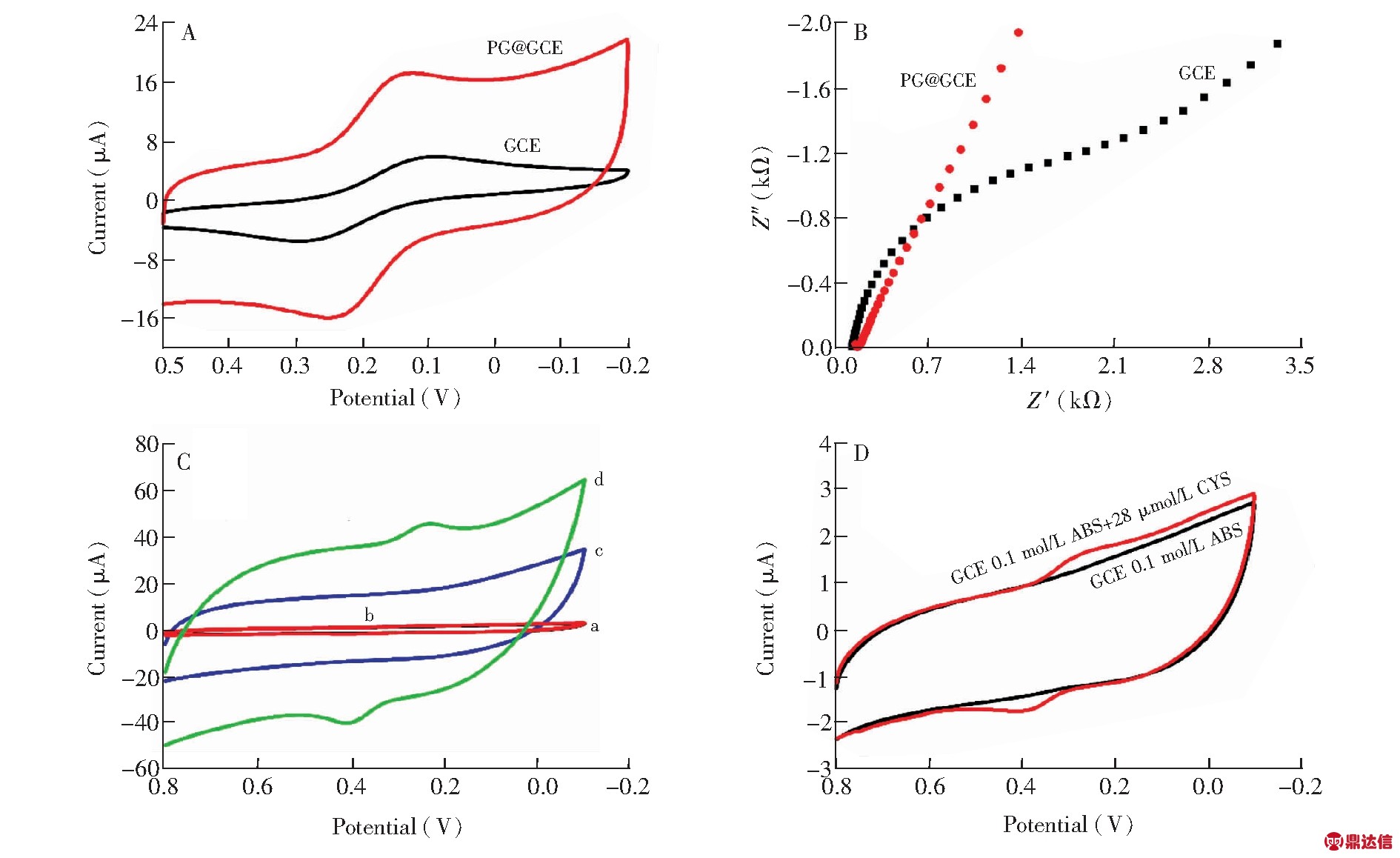
图4 GCE、PG@GCE在0.5 mmol/L [Fe(CN)6]3-/4-(含0.1 mol/L KCl)的探针溶液中进行循环伏安法(A)和交流阻抗法(B)的表征图;(C)GCE(a,b)和PG@GCE(c,d)在0.1 mol/L醋酸盐缓冲液(a,c)和含有2.8×10-5 mol/L CYS的0.1 mol/L醋酸缓冲溶液(b,d)中的循环伏安图;(D)GCE在0.1 mol/L醋酸缓冲液和含有2.8×10-5 mol/L CYS的0.1 mol/L醋酸缓冲溶液中的循环伏安放大图
Fig.4 (A) Cyclic voltammetry (CV) curves of GCE and PG@GCE in 0.5 mmol/L [Fe(CN)6]3-/4- containing 0.1 mol/L KCl solution.Scan rate is 100 mV/s;(B) Electrochemical impedance spectroscopy (EIS) of GCE and PG@GCE in 0.5 mol/L [Fe(CN)6)]3-/4- (0.1 mol/L KCl);(C) CV curves of GCE (a,b) and PG@GCE (c,d) in NaAc-HAc buffer solution (a,c) and NaAc-HAc buffer solution containing 2.8×10-5 mol/L CYS (b,d);(D) CV curves of GCE in NaAc-HAc buffer solution and NaAc-HAc buffer solution containing 2.8×10-5 mol/L CYS
3.5 实验条件的优化
3.5.1 修饰量的影响 电极表面PG的修饰量对CYS的氧化峰电流具有很大的影响。修饰到电极表面的PG量较少时,膜较薄,CYS在电极表面的富集量不足;修饰过量又会导致电子传递路径增加,电极灵敏度下降,电化学响应减小。图5A显示了修饰量对CYS氧化峰电流的影响,当用5 μL 1 mg/mL PG的异丙醇溶液进行修饰时,所得电极的氧化峰电流最大,因此选择5 μL为最佳修饰量。
3.5.2 pH值的影响 采用循环伏安法在pH 3.0~8.0范围内研究了缓冲液pH值对CYS电化学行为的影响。如图5B所示,氧化还原峰电位随着pH值的升高而负移,表明此电极反应有质子参与;图5D是Epa 与pH值的线性方程:Epa(V)=0.4343-0.04464pH,R2=0.9903,根据Nernst方程Epa=Eθ-[(2.303mRT)/(nF)] pH[32],可求得m/n=0.93,说明电极反应过程中转移的质子数与电子数相等;此外,pH=4.0时,氧化峰电流达最大(图5C),因此选择最佳pH值为4.0。
图5 (A)氧化峰电流Ipa与修饰量的关系;(B)不同pH条件下的循环伏安图;(C)氧化峰电流Ipa与pH值的关系;(D)氧化还原电位Epa与pH的关系;(E)不同扫描速率条件下的循环伏安图;(F)峰电流Ipa与扫描速率的平方根(ν1/2)间的关系;(G)峰电位Epa与扫描速率的对数logυ的关系;(H)氧化峰电流Ipa与富集时间的关系
Fig.5 (A) Plots of anodic peak currents against volume of modification solution (1 mg/mL PG);(B) CV curves of calycosin at different pH conditions;(C) Relationship between the formal redox potentials and pH;(D) Relationship between anodic peak currents and the pH.(E) CV curves of calycosin at different scan rates;(F) Relationship between peak currents and square root of scan rates (ν1/2);(G) Plots of anodic and cathodic potentials against logarithm of scan rate.(H) Relationship between anodic peak currents and accumulation time
3.5.3 扫描速率的影响 测量不同扫描速率条件下CYS(CYS)在PG@GCE上的循环伏安图(图5E),扫速在10~300 mV/s范围内,峰电流随着扫速的增加而增强,峰电流与扫速的平方根呈良好的线性关系(图5F),方程可表示为Ipa(μA)=3.4492ν1/2 (mV/s)1/2-7.2590,R2=0.9974,表明CYS在PG@GCE上的电极反应过程受扩散控制;在较高的扫描速率范围(200~300 mV/s)内,氧化峰电位和还原峰电位的数值均与扫速的对数呈良好的线性关系(图5G),方程可表示为Epa=0.2003lgν + 0.5787 (Epa: V,ν:V/s),R2=0.9968;Epc=0.0050-0.2567lgν(Epc: V,ν: V/s),R2=0.9925。根据Laviron’s方程[33,34]:
(2)
![]()
(3)
![]()
(4)
可计算出电子转移系数α=0.43,电子转移数n=0.53,电极反应速率常数ks=0.67/s,表明CYS在PG@GCE表面具有快速的电子转移过程。这是由于PG具有较大的比表面积,可以增加CYS在电极表面的负载量。另外,PG优良的导电性可以促进电极表面电子的快速转移,从而增强CYS的电化学响应信号。综上可知,PG为CYS提供了合适的电子传递微环境,促进了CYS的电化学反应,从而能够实现对CYS的灵敏测定。根据求得的电化学反应参数,进一步验证了CYS在电极表面的反应机理(图1所示)。
3.5.4 富集时间的影响 将修饰电极置于含有2.8×10-5 mol/L CYS的醋酸盐缓冲液(pH=4.0)中,选择开路电位搅拌富集,每隔30 s采用循环伏安法扫描一次,由图5H可知,CYS的还原峰电流随着富集时间的增加而增大,在5 min后,还原峰电流增加相对较平缓。 选择富集时间为5 min。
3.6 线性范围和检出限
在优化的实验条件下,选择灵敏度较高的差分脉冲伏安法(Differential pulse voltammetry,DPV)测定PG@GCE电极对含有不同浓度CYS溶液的响应(图6A)。由图6B可知,CYS的氧化峰电流和浓度在1.8×10-7~4.4×10-5 mol/L的范围内呈现良好的线性关系,线性方程表示为Ip(μA)= 0.2609C (μmol/L) + 0.1187,相关系数R2=0.9928,检出限为5.8×10-8 mol/L(S/N=3),与文献报道的分析方法相比(表1),本方法分析性能或优于或相当于文献方法。
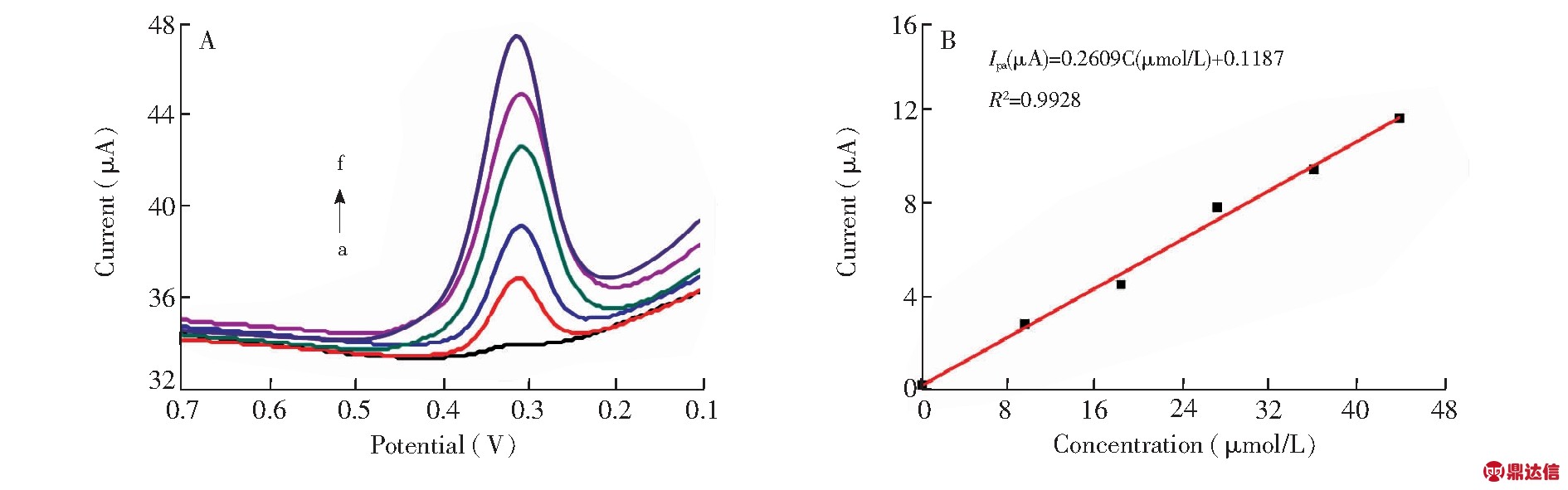
图6 (A)不同浓度CYS(a:0.176,b:9.560,c:18.421,d:27.280,e:36.133,f:44.012 μmol/L)在修饰电极上的差分脉冲伏安曲线;(B) CYS浓度与氧化峰电流间的关系
Fig.6 (A) Differential pulse voltammograms of different concentrations of CYS (a: 0.176,b: 9.560,c: 18.421,d: 27.280,e: 36.133,f: 44.012 μmol/L) on PG@GCE;(B) Calibration curve of anodic peak current versus concentration of CYS
表1 不同方法测定CYS的性能比较
Table 1 Comparison of different analytical methods for detection of CYS

3.7 传感器的重现性、选择性和稳定性研究
平行制备5支修饰电极,对相同浓度的CYS样品溶液(2.8×10-5 mol/L)进行测定,各测量值间的相对标准偏差为4.4%,表明构建的传感器具有很好的重现性。同一支修饰电极4℃保存1周后,对含有2.8×10-5 mol/L CYS的0.1 mol/L醋酸缓冲溶液进行测定时,其电化学响应信号为原始检测信号的95.7%,表明此传感器具有良好的稳定性。
考察了传感器的选择性。采用差分脉冲伏安法,在含有2.8×10-5 mol/L CYS的0.1 mol/L醋酸缓冲溶液(pH =4.0)中,分别加入槲皮素(Quercetin)和芒柄花素(Formononetin),终浓度为2.8×10-4 mol/L;加入甘氨酸(Glycine)、谷氨酸(Glutamic acid)、鼠李糖(L-rhamnose monohydrate)和蔗糖(Sucrose),使其浓度为1.4×10-3 mol/L;加入Fe3+、Cu2+、Mg2+、Ca2+、Cl-![]() 等干扰离子(Trace element),终浓度为2.8×10-3 mol/L。 由图7可知,在含有较高浓度的干扰物时,构建的电化学传感器用于CYS分析时,呈现出较佳的选择性。
等干扰离子(Trace element),终浓度为2.8×10-3 mol/L。 由图7可知,在含有较高浓度的干扰物时,构建的电化学传感器用于CYS分析时,呈现出较佳的选择性。
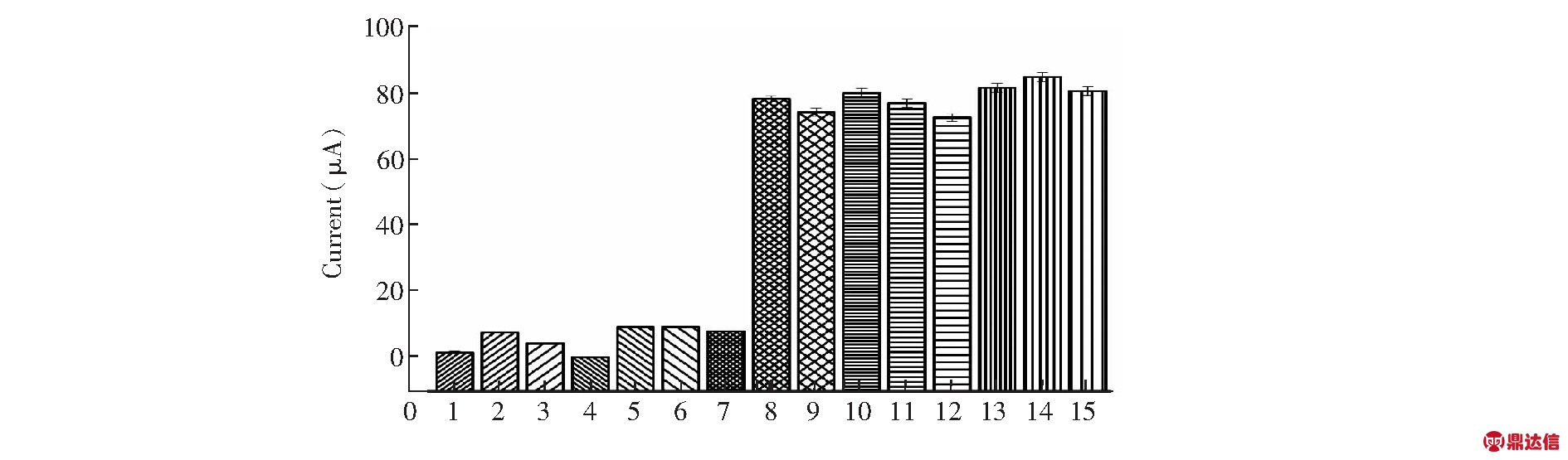
图7 测定CYS时不同物质的干扰
Fig.7 Interference of different species on DPV determination of CYS with this sensor
1: Quercetin,2: Formononetin,3: Glycine,4: Glutamic acid,5: L-rhamnose,6: Sucrose,7: Trace element [Fe3+、Cu2+、Mg2+、Ca2+、Cl-![]() 8: Calycosin,9: Quercetin + Calycosin,10: Formononetin + Calycosin,11: Glycine + Calycosin,12: Glutamic acid + Calycosin,13: L-rhamnose + Calycosin,14: Sucrose + Calycosin,15: Trace element + Calycosin
8: Calycosin,9: Quercetin + Calycosin,10: Formononetin + Calycosin,11: Glycine + Calycosin,12: Glutamic acid + Calycosin,13: L-rhamnose + Calycosin,14: Sucrose + Calycosin,15: Trace element + Calycosin
3.8 实际样品分析
3.8.1 黄芪、红芪中CYS(CYS)的测定 取100 μL制备的黄芪、红芪提取物作为待测样品,高效液相色谱法(HPLC)测定中药材黄芪和红芪中CYS含量为0.252和0.0765 mg/g,作为参照值。采用构建的传感器对CYS进行分析,结果如表2所示,加标回收率在96.2%~103.4%范围,表明PG@GCE电化学传感器可用于实际样品中CYS的检测。
表2 采用本方法测定黄芪和红芪中的CYS的结果
Table 2 Detection of CYS in Astragali Radix and Hedysari Radix using PG@GCE

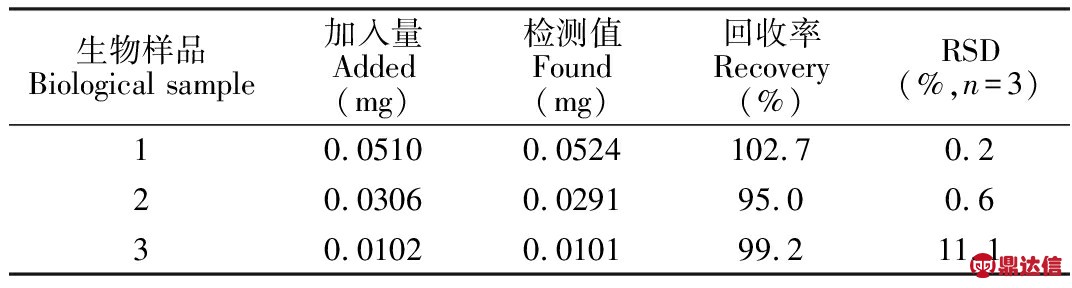
3.8.2 生物样本中CYS的测定 以制备的PG@GCE为工作电极,对血浆样品中CYS的含量进行分析。取500 μL经预处理后的血浆样品,用0.1 mol/L醋酸缓冲液(pH=4.0)稀释至10 mL,确保待测样品中CYS的浓度在PG@GCE工作电极分析的线性范围内,保持整个体系处于均匀状态,采用标准加入法,运用构建的传感器对血浆样品中CYS进行分析(表3),回收率在95.0%~102.7%范围内,表明PG@GCE电化学传感器可用于生物样本中CYS的测定。
表3 采用本方法测定生物样本中的CYS的结果
Table 3 Detection of CYS in biological samples using PG@GCE
4 结 论
制备了结构优化的中空网络结构PG,此PG具有大的比表面积和优良的导电性,可用于构建复杂体系中CYS痕量分析的电化学传感器,显著增加了CYS富集的活性位点,极大增强了CYS的电化学响应。在优化条件下,PG@GCE传感器对CYS呈现出较宽的线性范围和较低的检出限,以及良好的稳定性、选择性和较好的重现性。用于中药黄芪、红芪的提取物及血浆样品中CYS分析时,分析性能良好。本研究为中药黄芪和红芪中质量控制的指标性成分的快速检测及生物样品中CYS的痕量分析提供了一种新颖的分析方法,也扩大了PG在分析领域的应用。



