摘要 将核酸构象转换与纳米孔膜技术联用设计了一种新型高灵敏电化学传感器, 实现了对Hg2+, Pb2+和Sr2+的分步同时检测. 使用2种分别能与Hg2+及Pb2+, Sr2+结合的核酸适体, 将其固定在氧化铝纳米孔膜孔道内以阻碍铁氰化钾离子传导. 利用核酸适体包裹目标物时的蜷缩状态与目标物被洗脱剂洗脱后核酸适体的伸展状态之间的构象转换, 控制纳米孔通道的“开”和“关”, 使铁氰化钾溶液的氧化还原电流发生改变. 通过监测铁氰化钾溶液的电信号变化值, 可实现同时检测此3种金属离子的目的. 实验结果表明, 该传感器对3种金属离子具有很高的灵敏度和选择性, 检测的线性范围均为0.05~1.50 nmol/L, 对Hg2+, Pb2+和Sr2+的检出限分别为0.013, 0.017和0.022 nmol/L(S/N=3).
关键词 多孔阳极氧化铝; 汞离子; 铅离子; 锶离子; 生物传感器
环境污染, 特别是水环境中重金属离子含量超标等已成为困扰和阻碍人类社会发展的重大问题[1]. 水体中的Hg2+通过微生物作用可转变成剧毒的甲基汞, 由食物链进入人体, 引起汞中毒[2~4]; Pb2+会富集在水体中, 难以降解, 对人体的中枢神经系统、胃肠系统和免疫系统均有很高的毒性, 可导致贫血、神经损伤及肾损伤等病症[5,6]; Sr2+是人体所需的微量元素, 但过量的Sr2+会干扰钙的吸收与代谢, 可引起骨骼生长发育过快或骨骼变形, 所以Sr2+被认为是潜在威胁人类健康的金属离子之一. 因此, 水体中Hg2+, Pb2+和Sr2+的检测对人类健康和环境保护有重要意义.
目前, 对水样中Hg2+, Pb2+和Sr2+离子的检测方法有比色法[7]、色谱法[8,9]、质谱法[10]、荧光法[11~17]、原子吸收或发射光谱[18,19]和电化学法[20~23]等. 其中, 色谱法、原子光谱质谱法和荧光法等所使用的仪器较昂贵, 检测过程较为繁琐且检测成本高, 不利于在野外等简陋地区实时监测; 分光光度法受制于水样的清浊度等不适用微量检测. 电化学法因操作简便、成本低及易推广等特点而受到关注. 因此, 有必要建立一种可对多种有害离子同时快速检测的电化学方法以应对日益增长的环境保护及检测需求.
特定序列的寡聚核苷酸链(适体)具有类似于抗体的作用, 可与目标物如金属离子特异性结合, 如适体序列中的胸腺嘧啶(T)能够与Hg2+形成T-Hg-T, 包裹并捕捉Hg2+[24,25]; 含有较多的鸟嘌呤(G)序列的核酸链则能与Pb2+, Sr2+形成G-四联体结构而捕捉Pb2+与Sr2+[26,27]. 多孔阳极氧化铝(PAA)作为一种智能响应纳米材料已被广泛应用于高性能传感器的制备[28,29]. 氧化铝膜表面含有大量羟基, 易于功能化, 将其硅烷化后即可修饰多种生物识别分子[30].
本文将具有高特异性的适体技术与纳米孔膜技术结合, 建立了可用于金属离子Hg2+, Pb2+和Sr2+同时检测的高灵敏电化学生物传感器.
1 实验部分
1.1 试剂与仪器
多孔阳极氧化铝(PAA, 直径25 mm, 厚度为60 μm, 孔径分别为30, 50, 90和200 nm)购自上海上木科技有限公司; 硝酸铅(A. R.级)、氯化锶(A. R.级)和汞离子标准溶液均购自上海化学试剂公司; 巯基乙醇(βME, A. R.级)、藤宁四乙酸(DOTA, A. R.级)和[2,2,2]-穴醚(KP, A. R.级)均购自国药集团化学试剂有限公司(上海); 所有核苷酸序列均经高效液相色谱(HPLC)纯化并由上海生物工程技术服务有限公司合成, 核苷酸序列如下: H1: 5′-NH2-TCATCGTTCTTTCTTCCCCTTGTTTGTT-3′, H2: 5′-NH2-GGGTGGGTGGGTGGGT-3′; 实验所用水均为超纯水(电阻率>18 MΩ·cm), 由艾科浦超纯水系统制备.
CHI 660型电化学工作站(上海辰华仪器有限公司); pH分析仪(上海雷磁仪器有限公司); 水浴恒温振荡仪(上海博讯实业有限公司医疗设备厂).
1.2 Hg2+/Pb2+/Sr2+传感器的制备
将表面粘贴了PAA膜的玻碳电极浸入含有25%(体积分数)的3-氨丙基三乙氧基硅烷(APTES)的丙酮溶液中反应5 h; 再移入2.5%(体积分数)的戊二醛水溶液中避光反应12 h; 清洗后浸入含有1 μmol H1, 2 μmol H2, 0.1 g 1-(3-二甲氨基丙基)-3-乙基碳二亚胺(EDC)和25%(体积分数) N,N-二异丙基乙胺(DIPEA)的Tris-HCl缓冲液中, 于37 ℃恒温振荡培育12 h, 用Tris-HCl缓冲液洗涤后, 于4 ℃, 饱和湿度条件下保存, 备用.
1.3 样品检测
将上述Hg2+/Pb2+/Sr2+传感器置于含一定量Hg2+, Pb2+和Sr2+的水样中, 于37 ℃恒温振荡孵育20 min, 取出用Tris-HCl缓冲液洗涤, 置于5×10-4 mol/L K3Fe(CN)6溶液中, 在0~0.4 V范围内进行微分脉冲伏安(DPV)扫描, 记录扫描氧化峰电流值(I0). 然后, 将传感器置于1×10-8 mol/L的βME溶液中培育40 min, 洗涤后再置于5×10-4 mol/L K3Fe(CN)6溶液中, 测其氧化峰电流值(I1), 由I0-I1值即可计算出样品中Hg2+的含量.
样品中Pb2+和Sr2+的含量检测参照上述方法, 将传感器再依次置于1×10-7 mol/L DOTA和1×10-7mol/L KP溶液中培育、洗涤; 然后检测其在K3Fe(CN)6溶液中的氧化峰电流, 分别记为I2和I3. 通过I1-I2和I2-I3值分别计算出样品中Pb2+和Sr2+的含量.
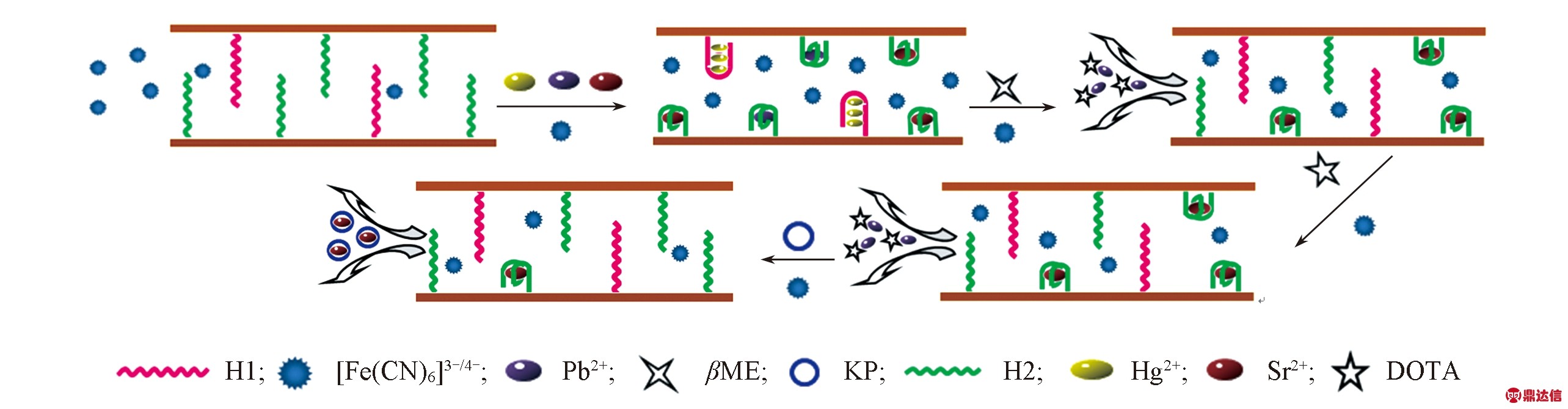
Fig.1 Schematic illustration of the proposed Hg2+/Pb2+/Sr2+-biosensor
2 结果与讨论
2.1 Hg2+/Pb2+/Sr2+传感器的表征
所设计传感器的工作原理如图1所示. 首先, 在PAA膜的纳米孔道内修饰能分别捕捉Hg2+, Pb2+和Sr2+的适体链H1与H2, 由于适体链的伸展构象使纳米通道内的空间变小且适体链本身所带有的大量负电荷也会对[Fe(CN)6]3-/4-产生强烈的排斥作用, [Fe(CN)6]3-/4-通过通道到达电极表面的运动受到阻碍, 导致电信号降低. 若体系中存在Hg2+, Pb2+和Sr2+, 这些离子可与其相应的适体链作用, 使
适体链构象由伸展变为蜷缩, 纳米通道被打开, 同时适体链所带的负电荷被中和, 电荷排斥作用减弱, 导致电化学信号增加. 当依次加入能与Hg2+作用的βME、与Pb2+作用的DOTA及能与Sr2+作用的KP时, Hg2+, Pb2+和Sr2+被依次从纳米孔道内洗脱出来, 而相应适体链构象则依次恢复到伸展状态, [Fe(CN)6]3-/4-在通道内的运动再次受到阻碍, 导致电化学信号降低. 基于此, 可通过采用不同的洗脱剂洗脱来实现在复杂体系中同时快速高效地检测微量Hg2+, Pb2+和Sr2+的目的.

Fig.2 SEM image of the bare PAAon the biosensor surfaces
由图2所示SEM照片可见, 未修饰的PAA膜表面十分光滑, 孔径约为30 nm. 将表面修饰PAA膜的电极放入K3[Fe(CN)6]溶液中进行微分脉冲伏安法(DPV)[图3(A)]和电化学阻抗谱(EIS)扫描[图3(B)], 得到的氧化电流很大, 阻抗值很小(曲线a); 当PAA膜上修饰H1链后, 其电信号急剧降低并伴随着阻抗值的急剧增大(曲线b), 与目标物Hg2+作用后, 电信号增强, 阻抗减少(曲线c), 这表明与汞离子结合后的H1链构象卷曲, 空间位阻变小, 且Hg2+的存在可部分中和通道内的负电荷, 有利于[Fe(CN)6]3-/4-进入通道. 此阶段传感器电流的增加值与Hg2+造成的适体链构象变化及通道内表面电荷改变有关, 即与PAA膜上适体链作用的离子数量有关. 传感器与洗脱剂βME溶液培育后, 其电信号又有所降低且阻抗值回升(曲线d), 这是由于Hg2+与βME之间的结合力强于T-Hg-T间的作用, Hg2+被βME洗脱出来, PAA膜中的H1链伸展并重新堵塞纳米孔道. 同样, 分别采用DOTA洗脱Pb2+和KP洗脱Sr2+的实验也得到了与βME洗脱Hg2+实验相同的结果(图S1, 见本文支持信息). 这说明目标金属离子在传感器上的捕捉和解析的可逆性好, 有助于传感器的重复使用.
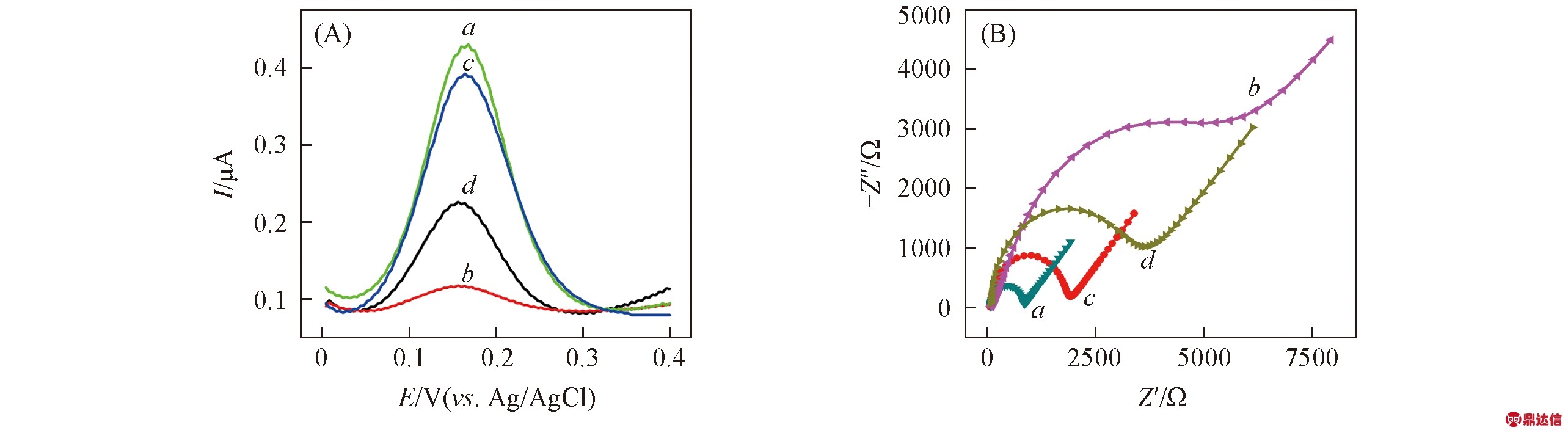
Fig.3 DPV(A) and EIS(B) curves for bare PAA(a), PAA modified with oligonucleotide H1(b), the biosensor incubated with Hg2+(c) and then eluted by βME(d)
Experimental conditions: 5×10-4 mol/L K3Fe(CN)6; 1×10-7 mol/L Hg2+; 1×10-8 mol/L βME.
通过适体链构象改变产生电信号的差别来检测金属离子时, 所选用的氧化铝纳米孔膜孔径至关重要, 这是由于电荷排斥及空间位阻的影响与纳米孔尺寸有关. 当PAA膜的孔径太小时, 适体链不能进入纳米通道; 而随着纳米孔孔径增大, 修饰在孔道内的适体链对铁氰化钾离子的阻碍作用会逐渐减弱; 当PAA膜的孔径太大时, 有无目标物的电信号差别不明显, 达不到检测的效果. 因此, 分别探讨了不同孔径的PAA膜对电化学信号的影响, 结果见图4. 当PAA膜的孔径为30 nm时, DNA的空间阻塞和电荷排斥作用非常明显, 峰电流变化最大; 当PAA膜孔径逐渐增大时, 峰电流变化值逐渐下降, 当PAA膜的孔径为200 nm时, 峰电流在洗脱目标金属离子前后无明显变化, 因此实验选择使用孔径为30 nm的PAA膜.
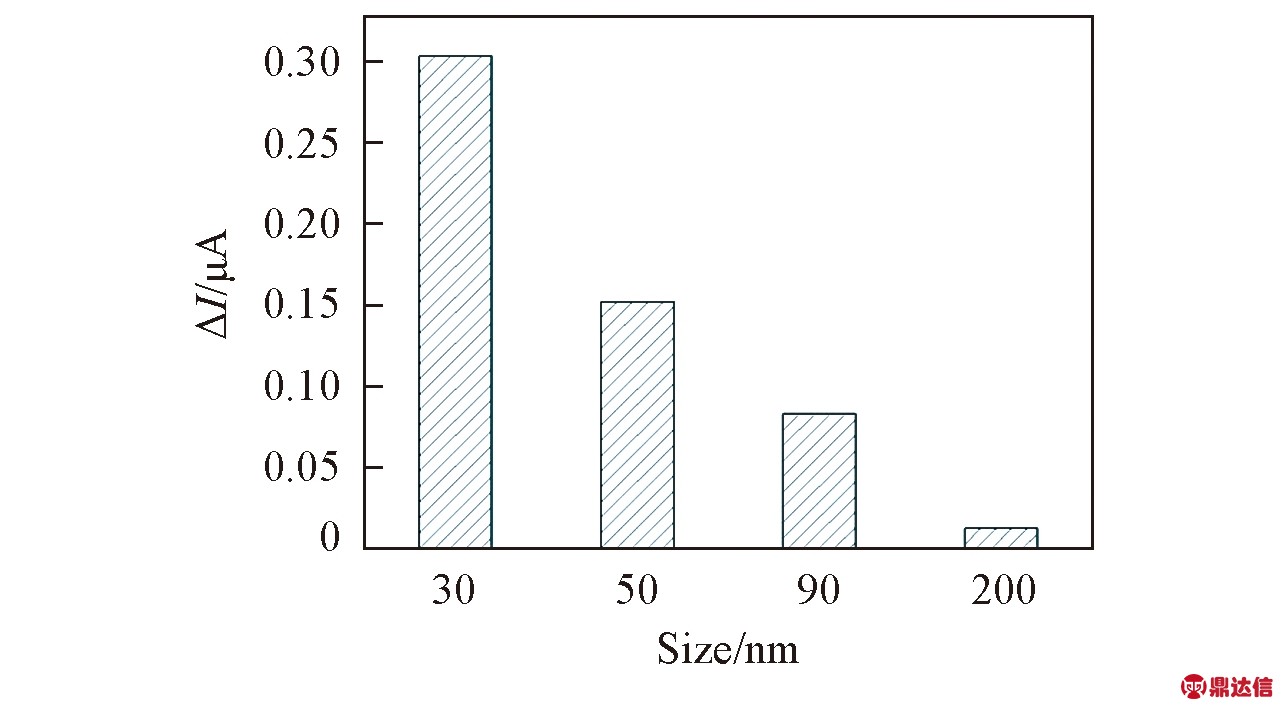
Fig.4 Effect of the size of PAA nanopore on the differences of the current between before and after incubation with Hg2+
Experimental conditions: 5×10-4 mol/L K3Fe(CN)6; 1×10-7 mol/L Hg2+; 1×10-8 mol/L βME.
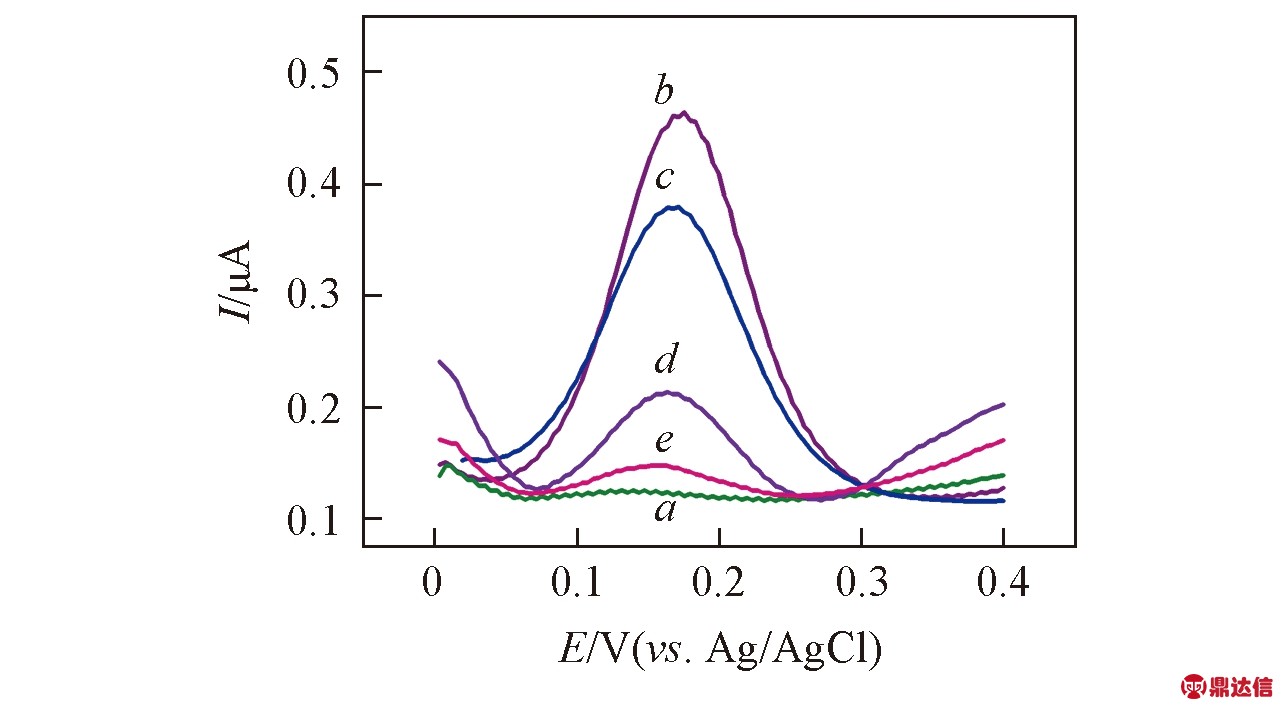
Fig.5 DPV curves of the entire detection process for PAA/H1/H2(a), incubated with the mixture of Hg2+, Pb2+ and Sr2+(b), eluted by βME(c), DOTA(d), and KP(e)
Experimental conditions: 5×10-4 mol/L K3Fe(CN)6; 1×10-7 mol/L Hg2+; 1×10-7 mol/L Pb2+ and Sr2+; 1×10-8 mol/L βME; 1×10-7 mol/L DOTA and KP.
适体链捕获离子后构象的改变使K3Fe(CN)6在传感器上的氧化峰电流增加并不能区分Hg2+, Pb2+和Sr2+ 3种不同目标离子. 需要采用不同的洗脱剂洗脱PAA膜上捕获的相应离子, 通过由此得到的峰电流降低值可实现3种离子的同时检测. 因此, 将捕获了Hg2+, Pb2+和Sr2+ 3种离子的传感器依次用βME, DOTA及KP溶液培育, 且每次培育后检测传感器在K3Fe(CN)6溶液中的氧化峰电流. 检测过程中电信号的变化如图5所示, 可见, 不同洗脱剂导致的峰电流降低值与相应离子从PAA膜上洗脱的量有关. 实验中还对洗脱剂与3种目标离子作用的速率常数(k)进行了测定, 结果列于表1. 其中, βME与Hg2+, DOTA与Pb2+及KP与Sr2+的反应速率均高于其它组合约1个数量级, 说明选用的洗脱剂可以满足选择性检测Hg2+, Pb2+和Sr2+的需要.
Table 1 Elution rate constants of Hg2+, Pb2+ and Sr2+

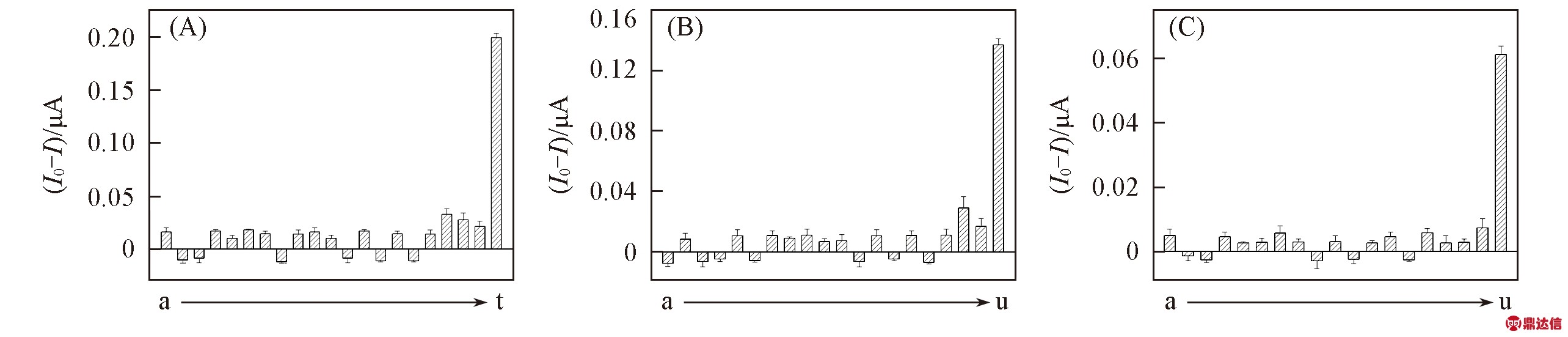
Fig.6 Specificity of the biosensor for the detection of Hg2+(A), Pb2+(B) and Sr2+(C)
a. Zn2+; b. Sn2+; c. Cu2+; d. Mn2+; e. Ni2+; f. Co2+; g. Cd2+; h. Ca2+; i. Mg2+; j. F-; k. Cl-; l. ![]() n. Ac-; o.
n. Ac-; o. ![]() q. S2-; r. Pb2+; s. Sr2+; t. the mixture of all the co-existent ions; u. the solution contains 10.0 nmol/L Hg2+, Pb2+ and Sr2+. Experimental conditions: 5×10-4 mol/L K3Fe(CN)6; 1×10-8 mol/L βME; 1×10-7 mol/L DOTA and KP.
q. S2-; r. Pb2+; s. Sr2+; t. the mixture of all the co-existent ions; u. the solution contains 10.0 nmol/L Hg2+, Pb2+ and Sr2+. Experimental conditions: 5×10-4 mol/L K3Fe(CN)6; 1×10-8 mol/L βME; 1×10-7 mol/L DOTA and KP.
2.2 实验条件的优化
为使每种洗脱剂达到对相应离子最佳的洗脱选择性, 对每种洗脱剂的浓度和洗脱时间进行了优化. 洗脱剂浓度优化结果如图S2(见本文支持信息)所示, 可见1×10-8 mol/L为βME对Hg2+洗脱的最佳浓度, DOTA和KP的最佳浓度均为1×10-7 mol/L. 由图S3(见本文支持信息)可知, Hg2+与βME的最佳培育时间为40 min, DOTA和KP 分别与Pb2+和Sr2+的最佳培育时间为30 min.
2.3 传感器的选择性
所构建的传感器建立在Hg2+, Pb2+及Sr2+离子与其适体链及洗脱剂具有特异性识别及结合的基础上. 为了验证其特异性, 在相同的实验条件下, 进行了多种阳离子和阴离子与3种目标离子共存的对比实验. 当干扰离子的浓度分别为待测3种离子浓度的100倍时, 检测结果如图6所示. 可见, 此传感器对Hg2+, Pb2+与Sr2+离子的特异性识别能力很强, 几乎不受其它干扰物质的影响.
2.4 传感器的再生性能
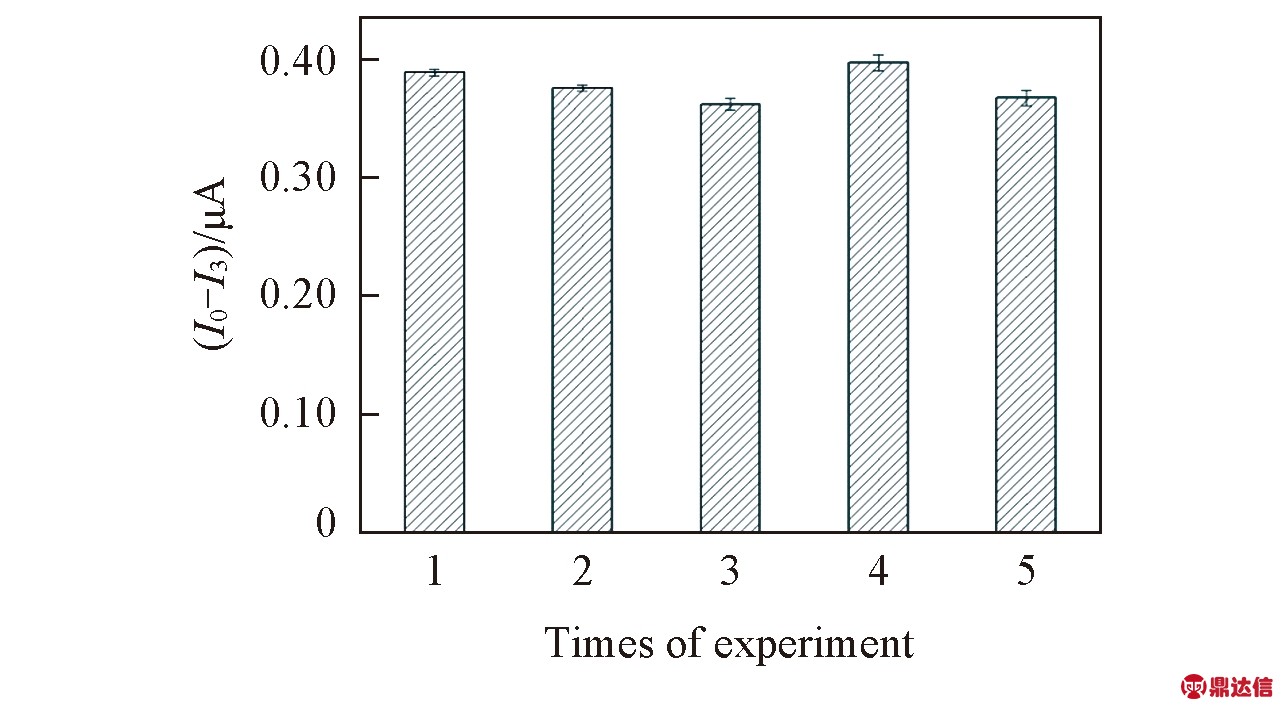
Fig.7 Regeneration of the biosensor
考察了该传感器的再生性能, 结果见图7. 连续实验5次, I0与全部离子洗脱后的I3之间差值变化在94.0%~103.4%之间, 表明该传感器再生性能好, 可重复使用.
2.5 方法的线性与分析应用
为了进一步证实传感器电化学信号与Hg2+, Pb2+与Sr2+离子浓度的关系, 在最佳实验条件下, 分别检测含有不同浓度的Hg2+, Pb2+与Sr2+溶液, 结果见图8(A)~(C). 当Hg2+, Pb2+和Sr2+浓度分别在0.05~2.5 nmol/L之间时, 其电流响应信号与浓度间呈良好的线性关系[图8(A′)~(C′)], 线性方程分别为y=0.07272×cHg2++0.01037(R2=0.9965), y=0.05787×cPb2++0.00521(R2=0.9982)及y=0.02677×cSr2++0.00345(R2=0.9939). 以3倍信噪比方法计算得到Hg2+, Pb2+和Sr2+的检出限分别为0.013, 0.017和0022 nmol/L.
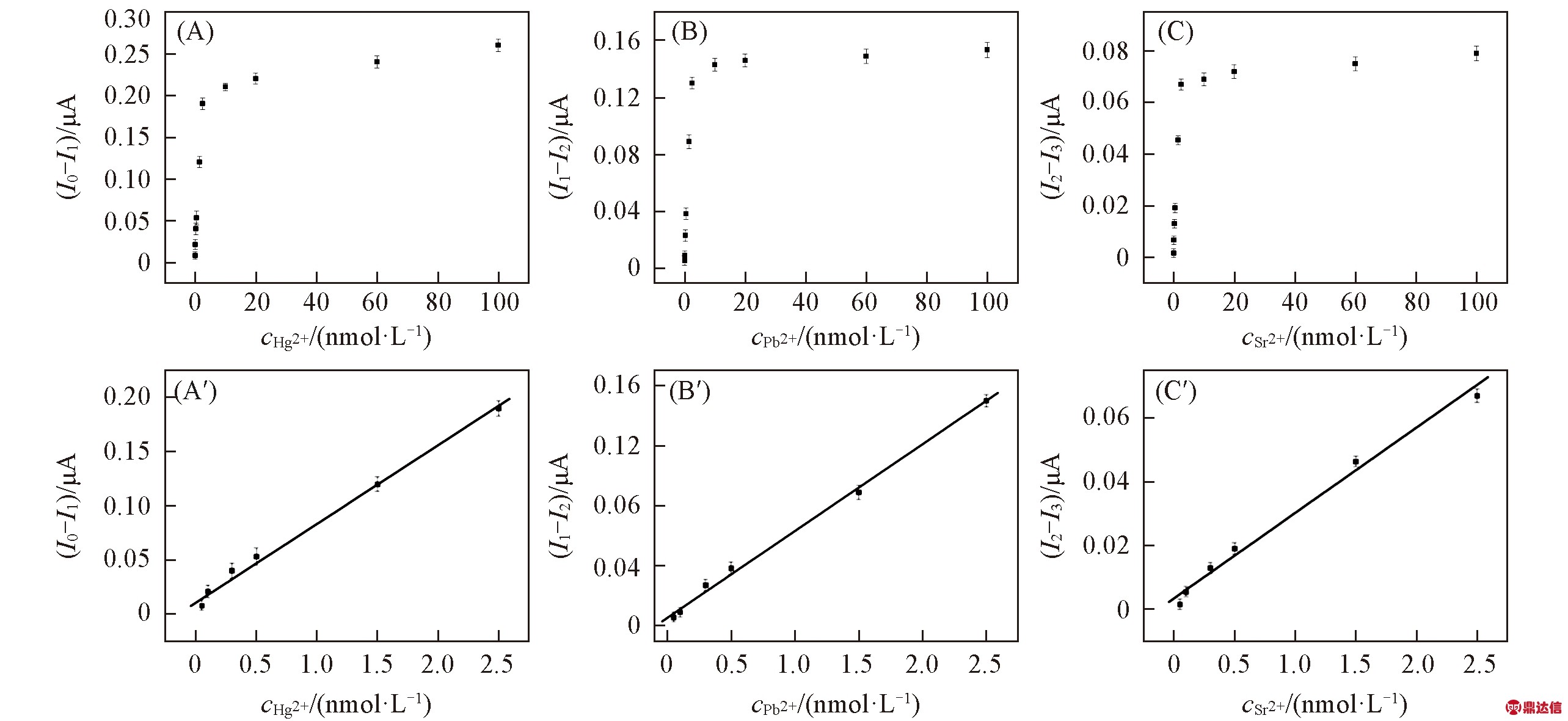
Fig.8 Calibration curves of the biosensor for the detection of Hg2+(A), Pb2+(B) and Sr2+(C) and linear relationships between the currents and the concentration of Hg2+(A′), Pb2+(B′) and Sr2+(C′)
实验选取3种实际水样进行了检测, 以验证该传感器检测样品中Hg2+, Pb2+与Sr2+的实用性, 结果列于表2. 可见, 自来水和饮用水中Hg2+, Pb2+与Sr2+均未被检出, 而河水中Hg2+和Sr2+离子含量分别为0.21和0.78 nmol/L, Pb2+未被检测到. 测得的加标回收率在90%~112%之间, 说明该传感器对实际水样中3种离子检测有良好的准确性.
Table 2 Quantitative detection of Hg2+, Pb2+ and Sr2+ in real samples*
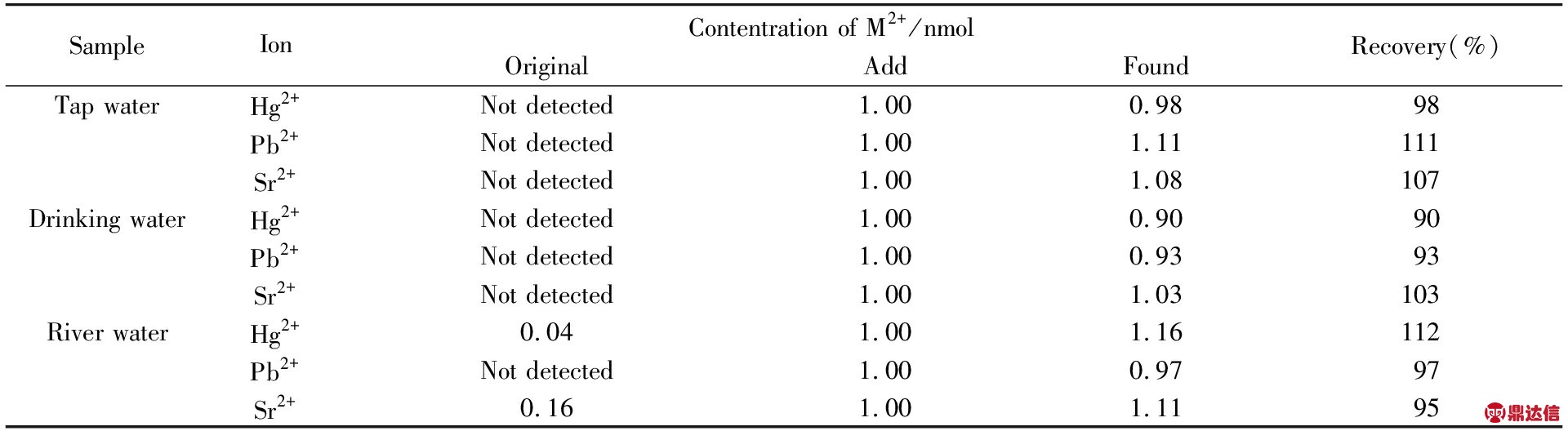
* All the data listed in the table are the average values of five individual experiments.
3 结 论
构建了一种基于核酸构象转换的可用于同时检测Hg2+, Pb2+与Sr2+离子的新型高灵敏生物传感器. 通过扫描电子显微镜、循环伏安和电化学阻抗谱分析表征, 验证了传感器组装和修饰过程的可靠性及对3种金属离子检测的可行性. 该传感器通过修饰适体链可以最大限度地调控PAA膜纳米通道内的铁氰化钾离子移动性能, 有效降低传感器背景信号. 只需极少量样品即可进行检测, 该方法对Hg2+, Pb2+和Sr2+离子的检出限分别达到0.013, 0.017和0.022 nmol/L, 显著提高了检测灵敏度. 在有大量干扰物质共存时该传感器仍能特异性检测Hg2+, Pb2+与Sr2+而不受干扰, 说明其适用于复杂的实际样品检测. 此外, 该传感器还具有再生能力, 可省去洗涤操作且大幅降低传感器使用成本, 并具有操作简便、检测时间短、灵敏度高及特异性好等特点, 可扩展用于多种不同目标物的同时检测. 有望发展成为便携式检测仪器, 在临床医学、医药工业和环境检测等领域取得进一步应用.



