摘要 背景:前期研究利用低温生物3D打印技术制备了丝素蛋白/Ⅱ型胶原蛋白复合支架,并证明其具有良好的力学性能;研究表明,力学刺激有利于骨骼重塑,并且梯度变化的加载应变有利于成骨细胞和破骨细胞的活化。
目的:在压缩应变下,将丝素蛋白/Ⅱ型胶原蛋白复合支架与软骨细胞共培养,观察细胞增殖变化,并观察丝素蛋白/Ⅱ型胶原蛋白复合支架修复软骨缺损的效果。
方法:采用低温3D打印技术制备丝素蛋白/Ⅱ型胶原蛋白复合支架,检测支架的孔隙率。将第3代小鼠软骨细胞ADTC-5接种于丝素蛋白/Ⅱ型胶原蛋白复合支架上,分别进行静态培养与力学载荷下培养:①静态培养:设置空白支架为对照,接种1,3,5,7,10,14 d,采用MTT法检测细胞增殖;②力学载荷下培养:设置空白支架为对照,接种1 d后,对细胞-支架复合物分别施加0%,1%,5%,10%,15%,20%的压缩应变,持续加载3 d,采用MTT法检测细胞增殖,扫描电镜和苏木精-伊红染色观察支架上的细胞分布、黏附和形态。在新西兰兔双侧膝关节制作直径3.5 mm的软骨缺损,左侧植入丝素蛋白/Ⅱ型胶原蛋白复合支架,右侧不植入材料,术后8周观察修复部位。
结果与结论:①支架孔隙率为(89.3±3.26)%,有利于细胞附着;②静态培养5 d后,软骨细胞在复合支架表面增殖良好;③施加0%,1%,5%,10%,15%,20%压缩应变组支架上的细胞增殖先升高后降低,其中施加10%压缩应变组细胞增殖效果最显著,施加20%压缩应变组增殖效果最低;④扫描电镜可见,施加0%压缩应变组软骨细胞多分布在支架表面有凹凸的地方,细胞形态明显,细胞触角伸展充分;施加10%压缩应变组支架受力接触表面上的软骨细胞极少,甚至没有,支架上首层侧面和内部表面细胞分布较多,细胞形态多为扁平状,触角明显;⑤苏木精-伊红染色显示,施加0%压缩应变组软骨细胞集中分布在支架表面,孔隙中几乎没有细胞;施加10%压缩应变组软骨细胞分布在支架孔隙内;⑥未植入支架的缺损处仍为圆形缺损模型,没有明显修复;植入支架的缺损处出现了类似透明软骨,但与周边缺损软骨没有发生粘连结合,新生的类透明软骨独立存在;⑦结果表明,在10%压缩应变作用下,软骨细胞在丝素蛋白/Ⅱ型胶原蛋白复合支架上增殖良好;丝素蛋白/Ⅱ型胶原蛋白复合支架可用于修复软骨缺损。
关键词:骨科材料;软骨支架;丝素蛋白/Ⅱ型胶原;压缩载荷;细胞增殖;缺损修复;生物材料
文章快速阅读:

文题释义:
丝素蛋白:由蚕茧缫丝脱胶而得到,常应用于临床修复和组织工程支架及作为改性材料,具有良好的生物相容性,无毒、无刺激性。
三维培养:是指将具有三维结构不同材料的载体与各种不同种类的细胞在体外共同培养, 使细胞能够在载体的三维立体空间结构中迁移、生长,构成三维的细胞-载体复合物。
0 引言 Introduction
关节软骨是覆盖在关节面上的结缔组织,本身无血管、神经和淋巴。很早以前就有学者发现关节软骨一旦损伤,自体修复能力非常有限[1],目前修复采用的治疗手段,如自体软骨移植、关节灌洗清理术、微骨折术等效果都不佳[2]。近年来,将组织工程学方法应用到软骨修复中一直都是研究的热点。种子细胞、支架材料和细胞生长调控因子被称为组织工程3大基本要素。其中,支架材料的性能直接影响着软骨修复过程。随着各种材料的研究开展,单一的材料已不能满足软骨缺损修复的理想要求,对2种或以上的不同材料进行物理、化学和生物方面的改性处理,保留优点,改善缺点,从而形成具有理想需求的新型复合材料,是近年来组织工程修复的热点。
丝素蛋白作为一种新的生物材料备受关注,国内外开展了将丝素蛋白材料应用于组织工程中的研究[3-6]。研究表明,丝素蛋白具有优越的机械和物理性能,可用于构建组织工程支架[7]。丝素蛋白作为支架,能够保持缺损部位的形状并诱导组织再生,这说明丝素蛋白的生物相容性比较好[8],但丝素蛋白在湿润环境中的机械强度不足。Ⅱ型胶原蛋白是软骨细胞外基质的重要成分,胶原占细胞外基质干质量的60%,而Ⅱ型胶原又占总胶原含量的80%。Ⅱ型胶原蛋白支架对软骨细胞的黏附、增殖及维持软骨细胞表型具有显著效果,并且对软骨细胞的分化和迁移具有诱导作用,有利于关节软骨的再生[9-13]。将丝素蛋白与Ⅱ型胶原蛋白复合,进行互相改性,可提升各自的性能。前期研究证明该支架的力学性能较好[14]。
此次研究利用低温生物3D打印技术,以质量比7∶3的丝素蛋白/Ⅱ型胶原蛋白混合材料为打印基质,制备出3D仿生人工软骨支架,接种软骨细胞ADTC-5,在力学载荷作用下分析支架材料的生物相容性,并初步探讨复合支架修复软骨缺损的可能性。
1 材料和方法 Materials and methods
1.1 设计 观察性实验。
1.2 时间及地点 实验于2017年9月至2018年6月在解放军军事医学科学院系统工程研究院后勤保障研究所完成。
1.3 材料
实验动物:4月龄新西兰大白兔,雌雄不拘,体质量约2.6 kg,由解放军军事医学科学院实验动物中心提供。
实验主要材料:试剂及仪器:天然桑蚕丝、新鲜牛肩胛骨(市场采购,中国);小鼠软骨细胞ADTC-5(天津中医药大学提供);DMEMF/F-12(1∶1)培养基(GIBCO公司,美国);胎牛血清(兰州百灵生物科技有限公司,中国);青、链霉素双抗混合液(北京索莱宝科技有限公司,中国);MTT-噻唑蓝(Sigma公司,美国);盐酸塞拉嗪注射液;Instron万能力学试验机(Instron公司,美国);冷冻干燥机(北京博医康公司,中国);CO2细胞培养箱(Forma Scientifis公司,美国);扫描电镜(Hitachi公司,日本);酶标仪A-5082(Thermo 公司,美国)。
1.4 实验方法
1.4.1 丝素蛋白的制备 ①脱胶:称取适量蚕丝,置于无水碳酸钠溶液中煮沸30 min,去离子水洗净,重复煮沸3次;②溶解:烘箱内60 ℃烘干丝素,剪碎,置于无水氯化钙、无水乙醇和去离子水摩尔比1∶2∶8的三空瓶中,60 ℃水浴搅拌4 h;③透析:将溶解后的液体置于截留分子质量为3 500 U的透析袋中,流动自来水透析2 d,去离子水透析1 d,每4 h换水1次;④离心:透析后的溶液以8 000 r/min离心10 min,取上清液;⑤浓缩:用聚乙二醇20 000浓缩后,通过测量质量分数为4.7%,置于4 ℃冷藏保存[15-18]。
1.4.2 Ⅱ型胶原蛋白的制备 取新鲜的牛肩胛骨,剔净多余的肌肉脂肪,用粉碎机将软骨粉碎,在无水乙醇中浸泡1 d,用去离子水浸泡清洗后,粉碎机再次粉碎,将软骨碎末在含胃蛋白酶的冰醋酸溶液中浸泡3 d,之后调节pH值至中性,加入氯化钠,收集析出的白色絮状物,放入透析袋中,在去离子水中透析4 d。置于4 ℃保存[19-21]。
1.4.3 低温3D单通道打印复合支架
打印基质:在前期研究的基础上,以质量比7∶3的丝素蛋白和Ⅱ型胶原蛋白混合溶液为打印基质,充分搅拌,进行70目和120目不锈钢过滤网依次过滤,装入10 mL注射器内,离心去气泡后等待打印。
打印方法:采用UG 10.0软件设计支架模型,导出为面积60 mm×60 mm、厚2 mm的长方体STL文件,设置打印参数:孔间距0.8 mm,层厚0.3 mm,打印速度15 mm/s,挤出速度0.25 mm/min。在-20 ℃的低温平台上打印成型[22-25]。将打印好的支架在真空状态下干燥36 h。干燥后,经过无水乙醇浸泡24 h,氢氧化钠浸泡24 h,无离子水浸泡72 h。将支架裁剪成尺寸为10 mm×10 mm的试样,60Co灭菌后备用。
1.4.4 支架孔隙率的测定 采用比重法来测量丝素蛋白/Ⅱ型胶原支架的孔隙率。取无水乙醇,加到50 mL离心管里,加满后称取质量,记为m1;取准备好的支架,称取质量,记为m2,放入到装满无水乙醇的离心管中,用真空泵抽取空气,直到浸透在无水乙醇的支架中无气泡冒出。之后用无水乙醇加满真空后的离心管,称取质量,记为m3。将支架取出后,称取剩下的质量,记为m4。支架的孔隙率计算公式如公式(1):
1.4.5 Micro-CT扫描观察 将除酸过后的支架样本置于Micro-CT系统检测试管中,以层距5 μm进行360°扫描,选择合适的区域和阈值,同时除去扫描材料边缘的伪影。将样品由Micro-CT扫描后的图片在Mimics 10.0中建立出3D模型,经三维逆重建软件Geomagic建立生成Nurbs曲面,从内部取模型的一部分,进行细微观察。
1.4.6 复合支架细胞相容性检测
在支架上接种软骨细胞:小鼠软骨细胞ADTC-5在培养瓶中长满后,用胰酶消化后,制成细胞浓度5×109 L-1细胞悬浮液备用。将提前在DMEM/F-12(1∶1)培养基中浸泡12 h的支架用PBS冲洗2次,用灭菌后的滤纸吸干水分,向每个支架缓慢滴加100μL细胞悬液,置于培养箱内孵育4 h,添加DMEM/F-12(1∶1)完全培养基,隔2 d换液1次。
静态培养:将接种后的支架在37 ℃、体积分数5%CO2的培养箱中静态培养,设立空白支架为对照。培养1,3,5,7,10,14 d,采用MTT法检测软骨细胞增殖情况。
不同压缩应变下的培养:接种细胞后的支架培养1 d后,分别施加不同的压缩应变(0%,1%,5%,10%,15%,20%)加载30 min,持续加载3 d,待所有载荷施加完成后,培养箱过夜培养。设立空白支架为对照。加载后,采用MTT法检测各实验组支架上细胞的增殖情况。
MTT检测方法:用PBS冲洗支架,用灭菌后的滤纸吸干支架上多余的液体,将细胞-支架复合物移入24孔板,每支加入5 g/L MTT溶液1 mL,在37 ℃、体积分数5%CO2培养箱中孵育4 h;将24孔板的MTT溶液吸出,在每孔加入DMSO 1 mL,在摇床充分溶解后,取150 μL溶液移至96孔板内;设定酶标仪波长为490 nm,将96孔板在酶标仪中,连续测量3次吸光度值。将试样中各孔的吸光度值减去96孔板中空白孔的吸光度值后,使用Origin软件进行分析各重复孔吸光度值的平均值,绘制时间-吸光度值曲线。
扫描电镜观察:取静态培养3 d的支架和施加10%压缩应变的支架,进行扫描电镜观察,观察软骨细胞在支架上的分布、黏附和细胞伸展的形态。扫描电镜步骤如下:取出试样,用PBS冲洗支架3次,加入2.5%戊二醛溶液,在 4℃冰箱中固定过夜后,使用1%锇酸室温下固定;经乙醇梯度(50%,70%,80%,90%和100%)脱水,之后将支架进行临界点干燥,喷金处理后扫描电镜下观察。
苏木精-伊红染色:在取静态培养3 d的支架和施加10%压缩应变的支架,进行苏木精-伊红染色。培养箱内取出样本,PBS冲洗,用滤纸吸干支架上多余的液体后,经体积分数4%甲醛溶液室温过夜固定,进行石蜡包埋,将支架按5 μm厚度连续切片,逐级脱水、透明及封固,苏木精-伊红染色后显微镜下观察。
1.4.7 复合支架软骨缺损修复实验 取2只新西兰大白兔,将盐酸塞拉嗪注射液按照1.5 mg/kg的比例肌肉注射,待其完全麻痹后,剪去后腿股骨关节处兔毛,用碘酒涂抹去毛部位,无菌洞巾铺在膝关节部位,用手术刀在大腿内侧膝关节处划开外皮,切开内部肌肉和肌腱,暴露股骨末端软骨,通过圆形限位器制作3.5 mm直径缺损边缘,用手术刀刮除缺损区内软骨,左侧将直径为3.5 mm的圆形支架放入缺损位置(实验组),右侧未植入支架(对照组),缝合肌肉和外皮。用含有抗生素的生理食盐水冲洗伤口,放入饲养笼里。
饲养8周后,耳缘静脉注射50 mL空气栓塞处死兔,将其放在手术台上,观察腿部伤口愈合状况。手术刀切开包裹在关节上的外皮和肌肉,暴露关节部位,观察修复效果。
1.5 主要观察指标 施加压缩应变后,丝素蛋白/Ⅱ型胶原蛋白复合支架的细胞相容性;丝素蛋白/Ⅱ型胶原蛋白复合支架修复兔软骨缺损的效果。
1.6 统计学分析 针对实验中的重复结果,采用SPSS 19.0进行重复性分析。文中的数据均为平均值,误差带表示数据的标准偏差。对独立实验样本进行检验:检验水准α=0.05。
2 结果 Results
2.1 复合支架的表观和微观结构 制备后的丝素蛋白/Ⅱ型胶原蛋白支架,见图1所示,支架材料整体呈白色,结构规则,孔径大小均一;打印后的支架经过30倍率放大,可观察到丝柱因不同层支架的压力呈扁平状;将支架的丝柱经过200倍率放大,可看到冷冻干燥后的孔隙结构。干燥后的支架表现为脆性,经PBS浸泡后质地比较柔软,弹性好。

图1 丝素蛋白/Ⅱ型胶原复合支架表观和微观结构
Figure 1 Appearance and microstructure of the silk fibroin/type II collagen composite scaffold
图注:支架材料整体呈白色,结构规则,孔径大小均一;扫描电镜下可见丝柱呈扁平状,冷冻干燥后呈孔隙结构。
2.2 复合支架的孔隙率 丝素蛋白/Ⅱ型胶原蛋白复合支架的孔隙率为(89.3±3.26)%,数值表现出了支架显著的孔隙率,与扫描电镜下丝柱展现出的孔隙结构一致。苏木精-伊红染色结果也可证实这一结论,见图2,支架的丝柱中全部充满着孔隙结构,几乎没出现区域性的实体无孔隙结构。

图2 丝素蛋白/Ⅱ型胶原蛋白复合支架苏木精-伊红染色观察(×30)
Figure 2 Hematoxylin-eosin staining of the silk fibroin/type II collagen composite scaffold (×30)
图注:支架的丝柱中全部充满着孔隙结构,几乎没出现区域性的实体无孔隙结构。
2.3 复合支架的 CT扫描观察 通过调试选择合适的CT阈值,消除所选区域中的空洞和区域边缘的伪影,经过三维逆重建后,见图3所示,支架材料孔分布均匀、孔形较为规则,多为方形,通透性较好,结构稳定。

图3 Micro-CT 扫描后逆重建的丝素蛋白/Ⅱ型胶原蛋白复合支架3D模型(右图为局部放大图)
Figure 3 3D model of the silk fibroin/type II collagen composite scaffold inversely reconstructed after Micro-CT scan (right image is of local magnification)
图注:支架材料孔分布均匀、孔形较为规则,多为方形,通透性较好,结构稳定。
2.4 MTT实验检测细胞增殖结果
2.4.1 静态培养下的软骨细胞增殖 图4显示了静态培养下复合支架上的软骨细胞增殖情况。接种细胞复合支架不同时间点的吸光度值高于未接种细胞的空白支架(P <0.01),表明复合支架对软骨细胞的吸附性较好。接种1,3 d,复合支架上的细胞增殖无差异(P > 0.05),这可能由于转换了新的环境,刚附着的软骨细胞增殖比较缓慢;在5 d以后的细胞增殖快于1,3 d(P < 0.05),说明软骨细胞在复合支架上增殖良好。空白支架各个时间点的吸光度值无明显差异(P > 0.05),这表明空白支架对MTT结果几乎无影响。
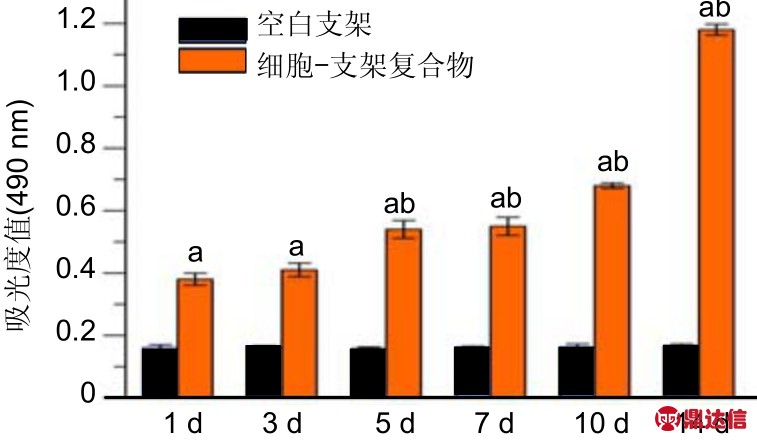
图4 软骨细胞在丝素蛋白/Ⅱ型胶原蛋白复合支架上的增殖
Figure 4 Proliferation of chondrocytes on the silk fibroin/type II collagen composite scaffold
图注:与空白支架比较,aP < 0.01;与1,3 d细胞-支架复合物比较,bP < 0.05。
2.4.2 不同压缩应变下的软骨细胞增殖 图5显示不同压缩应变下复合支架上的软骨细胞增殖情况。在施加压缩应变的情况下,细胞增殖先升高后降低,说明不同压缩应变对细胞增殖的影响不同,其效果呈一定程度的依赖性。与施加0%压缩应变组相比,施加10%压缩应变组的细胞增殖明显(P < 0.01),表明10%压缩应变可明显促进支架上软骨细胞的增殖;施加20%压缩应变对软骨细胞增殖有明显抑制作用(P < 0.05)。说明10%压缩应变为软骨细胞在支架上的最适载荷。

图5 不同压缩应变下丝素蛋白/Ⅱ型胶原蛋白复合支架上的软骨细胞增殖
Figure 5 Proliferation of chondrocytes on the silk fibroin/type II collagen composite scaffold under different compressive strains
图注:与施加0%压缩应变组相比,aP < 0.01,bP < 0.05。
2.5 扫描电镜观察细胞在支架上的黏附 图6A显示,静态培养下的软骨细胞多分布在支架表面有凹凸的地方,细胞形态明显,细胞触角伸展充分,图中箭头指示的是单个细胞。图6B显示,施加10%压缩应变支架受力接触表面上的软骨细胞极少,甚至没有,说明力学加载对处在表面的细胞有明显的抑制效果,支架上首层侧面和内部表面细胞分布较多,细胞形态多为扁平状,触角明显,图中箭头指示的是单个细胞。

图6 软骨细胞在丝素蛋白/Ⅱ型胶原蛋白复合支架上的分布及形态(扫描电镜)
Figure 6 Distribution and morphology of chondrocytes on the silk fibroin/type II collagen composite scaffold under scanning electron microscope
图注:图中A为未施加压缩应变的情况下,软骨细胞多分布在支架表面有凹凸的地方,细胞形态明显,细胞触角伸展充分(×100);B为施加10%压缩应变后,支架受力接触表面上的软骨细胞极少,甚至没有,支架上首层侧面和内部表面细胞分布较多,细胞形态多为扁平状,触角明显(×200);箭头指示单个细胞。
2.6 苏木精-伊红染色观察细胞在复合支架上的黏附图7A显示的是静态培养支架上的软骨细胞分布,软骨细胞集中分布在支架表面,孔隙中几乎没有细胞;图7B显示的是压缩应变支架上的软骨细胞分布,软骨细胞分布在支架孔隙内。说明压缩应变的作用使软骨细胞增殖至支架内部,压缩应变作用扩大了细胞生长的空间范围。
2.7 复合支架修复软骨缺损实验结果 图8A显示,兔腿部伤口愈合状况很好,无炎性症状,几乎看不到瘢痕;图8B显示,未植入支架的缺损处没有新软骨产生,缺损处仍为圆形缺损模型,触摸有骨质感,周围软骨略有松软感,没有明显的修复;图8C显示,植入支架的缺损处出现了类似透明软骨,呈乳白色,但与周边缺损软骨没有发生粘连结合,新生的类透明软骨独立存在,材料已完全失去了原有的形态,说明支架在体内发生了降解。

图7 软骨细胞在丝素蛋白/Ⅱ型胶原蛋白复合支架上的生长情况(苏木精-伊红染色,×200)
Figure 7 Growth of chondrocytes on the silk fibroin/type II collagen composite scaffold (hematoxylin-eosin staining, ×200)
图注:图中A为未施加压缩应变的情况下,软骨细胞集中分布在支架表面,孔隙中几乎没有细胞;B为施加10%压缩应变后,软骨细胞分布在支架孔隙内。
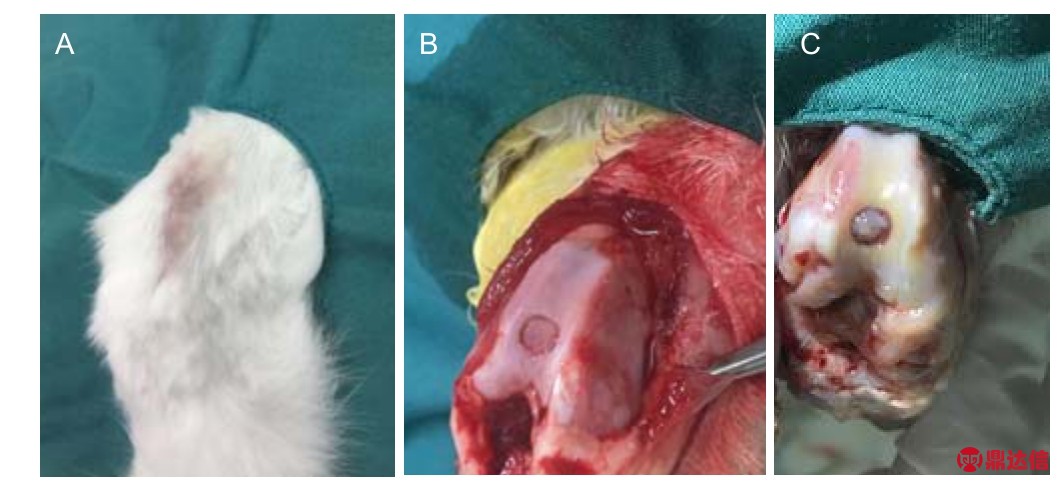
图8 丝素蛋白/Ⅱ型胶原蛋白复合支架修复兔软骨缺损8周后的大体观察
Figure 8 Gross observation of cartilage defects at 8 weeks after repair by the silk fibroin/type II collagen composite scaffold
图注:图中A显示伤口愈合状况很好,无炎性症状及瘢痕;B显示未植入支架的缺损处没有新软骨产生,缺损处仍为圆形缺损模型;C显示植入支架的缺损处出现了类似透明软骨,呈乳白色,但与周边缺损软骨没有发生粘连结合,新生的类透明软骨独立存在。
3 讨论 Discussion
3.1 细胞培养的创新性与优势 细胞在组织工程支架上的吸附和增殖,是学者一直致力解决的问题。研究通过2种方式来改善这一问题。首先,实验将先进低温3D打印技术和冷冻干燥法相结合,优势在于:可制备外形结构复杂的试件,而且可控制其内部微结构。低温平台可让蛋白材料快速塑形,解决了以前材料在打印过程中低层支架自动解体的问题。真空状态下的冷冻干燥方法对组织工程支架有较好的制孔作用。2种方法的结合,使材料的孔隙率得到了显著提高,提高了组织工程支架在接种时的细胞吸附率。前期研究表明,力学刺激有利于骨骼重塑,而且梯度变化的加载应变有利于成骨细胞和破骨细胞的活化[26]。在三维培养条件下,支架材料有对应力屏蔽及应力集中现象[27],表观应力对支架上软骨细胞的影响是不确定的,所以实验引入压缩载荷来寻找对细胞增殖效果最佳的力学刺激。
3.2 复合支架生物相容性分析 实验测试了软骨细胞对力学刺激的敏感度。MTT检测结果显示,压缩应变在10%时,软骨细胞增殖效果最好。通过扫描电镜观察发现,静态培养的软骨细胞分布在支架表面,压缩加载组支架上首层侧面和内部表面软骨细胞分布较多,细胞生长状态较好,触角伸展充分。苏木精-伊红染色结果发现,压缩载荷可扩大软骨细胞的生存空间,软骨细胞可增殖至支架内部,而静态培养下的软骨细胞分布在支架表层。支架材料修复软骨缺损的实验初步展示,未植入支架的缺损无明显生长修复情况发生,没有新的软骨产生;植入空白支架的缺损处出现了类似透明软骨,新生的类透明软骨独立存在。
以上研究结果表明在压缩载荷作用下,三维复合支架上的软骨细胞增殖效果比静态培养下的好,而且10%压缩应变促进软骨细胞增殖的效果最好。软骨缺损实验表明,支架材料在缺损处发生了类软骨演变,为后期软骨细胞-复合支架修复软骨缺损提供了参考。



