摘要:燃料电池和金属−空气电池作为目前最具发展前景的能量转换和储存设备,对于缓解人类发展所面临的能源与环境问题大有裨益。然而,较差的氧电极反应,如燃料电池中的氧还原反应以及锌空电池中的氧还原及析氧反应,却限制着这两类装置的高效运行。近年来,人们提出了利用单原子催化剂(SACs)来提高氧电极反应的反应动力学。因此,针对两类氧电极反应,本综述根据构成活性位点的不同金属元素进行了分类总结,重点关注了各类催化剂的共性及进展。同时,还对具有双功能的催化剂及其在锌空电池的应用进行了总结。最后,针对SACs 目前存在的问题和未来的发展方向提出了建议,旨在为单原子氧电极催化剂的设计及发展指明道路。
关键词:单原子催化剂;氧还原反应;析氧反应;双功能催化剂;燃料电池;锌空电池
引 言
以化石燃料为主导的能源是推动经济发展的主动力。然而,化石能源的短期不可再生性以及使用其所带来的温室效应,迫使人们寻求更为清洁的能源并将其高效地进行转换。因此,高效的清洁能源转换装置成为了目前研究的重点。其中,燃料电池和金属−空气电池以其较高的理论能量和功率密度脱颖而出,成为最具发展前景的能量转换和储存设备[1−4]。这两类装置都彻底摆脱了化石能源的使用,对于解决人类发展所面临的能源与环境问题有极大裨益。其中,燃料电池(fuel cells, FCs)所用阴阳极催化剂作为其中一类关键材料,对实现燃料电池的高效运行有着重要意义。燃料电池包含两个半反应,以酸性电解质下氢燃料电池为例:氢气在阳极被氧化成为质子的氢氧化反应(hydrogen oxidation reaction,HOR)以及氧气在阴极耦合电子及质子最终生成水的氧还原反应(oxygen reduction reaction,ORR)。相比于阳极的HOR,氢燃料电池的ORR 过电位较大、反应动力学迟滞[5−7],对催化剂的性能提出了更高的要求,因此开发高性能的ORR催化剂成为了提升燃料电池效率的关键。而作为一种二次电池,金属−空气电池(metal−air batteries,MABs)具有与燃料电池类似的半开放系统,需要外部供给的原料O2参与放电反应。同时,其充电过程还需要在氧电极上发生氧析出反应(oxygen evolution reaction,OER)。因此,相比于燃料电池,影响金属−空气电池充放电效率的核心反应包括ORR 和OER 两类反应。而这两类反应在MABs 中反应过电位大、动力学迟滞,同样也需要采用催化剂以加快反应速率[8−11]。因此,为了实现MABs 的大规模使用,高效氧电极的开发成为了必然选择。
纵观所有催化剂,贵金属催化剂(如Pt、Pd、Ir、Rh 等)独特的表面电子结构和相对较高的标准电极电位赋予了其较优良的催化活性以及耐蚀性,因而受到研究者们的重点关注。其中,铂基催化剂被认为具有最优良的氧还原催化活性,是最接近大规模商业化应用的贵金属氧还原催化剂。但是,铂的资源储量较低,成本居高不下,严重限制了燃料电池的发展。同理,其他贵金属催化剂(如在OER 反应中表现优良的IrO2,RuO2催化剂)也同样面临使用成本高昂、资源稀缺的窘境。因此,提高贵金属的利用效率以降低贵金属的使用量或者采用无贵金属的催化剂以代替贵金属催化剂成为了当前氧电极开发的重点。
为了在氧电极反应中实现低或无贵金属化,开发更为高效的氧电极材料成为了一条重要的途径。首先,对于贵金属催化剂而言,提高贵金属的利用率是开发高效氧电极催化剂必须要解决的问题。其次,对于非贵金属催化剂而言,如何调整非贵金属催化剂的活性使之媲美贵金属催化剂则是发展该类催化剂必须要探讨的问题。最后,无论是贵金属催化剂还是非贵金属催化剂,了解其活性中心催化氧电极反应的机理,从而寻找催化剂结构与性能的构效关系,建立结构描述符用于设计催化剂也是开发高性能氧电极催化剂的关键之一。而开发单原子催化剂(single−atom catalysts, SACs)作为氧电极材料就能非常好地解决上述问题。SACs,顾名思义是将孤立的相互之间没有联系的原子分散在载体上形成的催化剂[12−24]。与纳米颗粒和金属团簇催化剂相比,SACs不同的结构特征使得其在众多催化反应中具有更为优异的活性、选择性和耐久性。首先,单个金属原子的不饱和配位效应使得其可作为许多反应的活性中心。其次,孤立的金属原子增强了SACs 中的金属−载体的强相互作用(SMSI),保证了金属原子与支撑体之间的电子转移,从而能够有效地调节金属原子的电子结构。第三,由于量子尺寸效应的存在,SACs中的金属原子总是表现出独特的HOMO–LOMO 间隙和离散的能级分布,从而形成了独特的能级结构。最重要的是,SACs中的单原子结构使得其可以在催化反应中实现100%的理论原子效率。因此,SACs中单分散的活性位点可以大大提升金属原子的利用率,这意味着贵金属的使用量可以显著降低,从而降低催化剂的成本。因此,大量的以Pt、Ru 和Ir 等贵金属为原料的SACs 催化剂得到了较好的发展[25−30]。这些催化剂的贵金属载量远远低于纳米颗粒催化剂,但却具有更高的质量活性,为实现降低氧电极贵金属用量提供了一条出路。另一方面,人们也开发了非常多的非贵金属催化剂用于替代贵金属催化剂[31−42]。同样地,以非贵金属为基础的SACs 也表现出了更为突出的催化活性。由于SMSI的存在,非贵金属的活性位点可以被有效调节,这使得这些非贵金属SACs可以达到与贵金属媲美甚至超越贵金属催化剂的活性。此外,SMSI 还确保了这些SACs 的耐用性,使得这些非贵金属SACs能克服严苛的腐蚀环境,为其在酸性介质中的使用提供了机会。不仅如此,SACs中单分散活性位点的独特结构还可以为清晰地认识活性位点的实际内在性质及其在三相边界上的催化机制提供一个平台。
基于此,本综述总结了近年来SACs在氧电极反应中的发展情况,主要关注了以不同元素作为活性位点的催化剂,并总结归纳了各类催化剂的特点以及改性方法。最后,还探讨了目前的挑战和SACs氧电极催化剂未来的发展前景。
1 氧电极反应的基本机理
高职生是一个相对特殊的受教育群体,他们在心理和生理上都处在逐渐成熟的阶段,由于家庭情况、生源地区等方面的差异,他们的个体差异较大,在英语方面表现尤为明显,有些学生入学时的高考成绩有100多分,而有的还不到50分;另外,他们在中学阶段已经接受过一些传统的教学模式的影响,观念和习惯上较为固化。培养他们的学习自主性有一定的难度,但也有其可行性.经过实践和调查,以下各因素对其可行性的实现起到至关重要的作用。
1.1 ORR
对于ORR 反应,根据反应介质的不同,参加反应的离子和产物会有所不同。但总的来说,完整的ORR 过程均涉及了四个电子以及质子[酸性环境(H+)或中性环境及碱性环境(H2O)]的转移及反应。根据反应途径的不同,ORR 的反应过程主要分为两种:“直接”四电子过程以及“两步”二电子过程。用于燃料电池的ORR 催化剂以催化发生四电子反应为优,即氧气通过四电子反应直接生成水。而“两步”二电子过程,由于中间产物HO2−(中性环境及碱性环境)或者H2O2(酸性环境)的产生,其会聚集甚至不发生后续的第二步电子过程,使得ORR 反应效率下降,不利于燃料电池的功率输出。
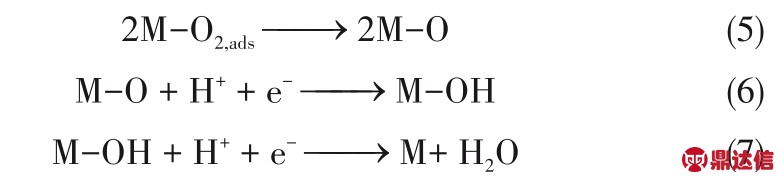
但实际上,ORR 这样一个涉及四个电子的反应,其实是由非常多的基元步骤组成的。首先,O2分子通过电解液扩散到金属表面发生化学吸附。吸附的方式可能存在两种:内氛机制和外氛机制。
内氛机制:
外氛机制:
通过内氛机制,金属原子核吸附O2分子直接作用;而外氛机制,金属原子则最终吸附O22−离子。然后,无 论 是 吸 附 态O2 分 子 还 是O22−离 子 均 会 发 生O—O键的断裂。断裂方式目前有三种。
第一种为直接解离形式:
第二种为联合机理:
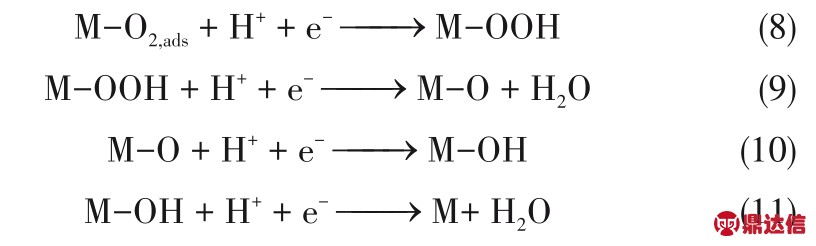
第三种机理“2+2机理”,即“两步”二电子过程:
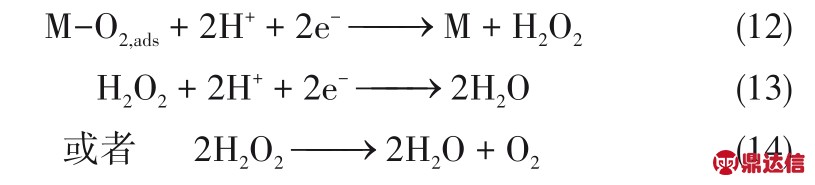
因此,从热力学角度来看,氧还原反应包括“质氧扩散—化学吸附—质电耦合—解吸附”四个过程,其中催化剂与氧气的化学吸附结合力越强越有利于催化O—O键断裂,而催化剂与还原产物−OHads、−OH2ads结合力越弱越有利于产物的脱附。只有当两种结合力强弱适中,即催化剂对O2的化学结合力足够强,对还原产物−OHads、−OH2ads结合力足够弱时,氧还原反应才能够高效顺利进行。如图1[43]所示,描述吸附自由能差与ORR 催化活性的火山型关系被提出,可以看出Pt 处于火山图的最高点,说明Pt 有最佳的含氧物种吸附能,所以就有最佳的氧还原催化活性。
1.2 OER
OER 作为ORR 过程的逆过程,同样包含四个基元步骤。根据反应介质的不同,其反应机制有所差别。在酸性和中性介质中,O2分子来源于H2O分子;而在碱性介质中,OH−则被认为是O2的前体。
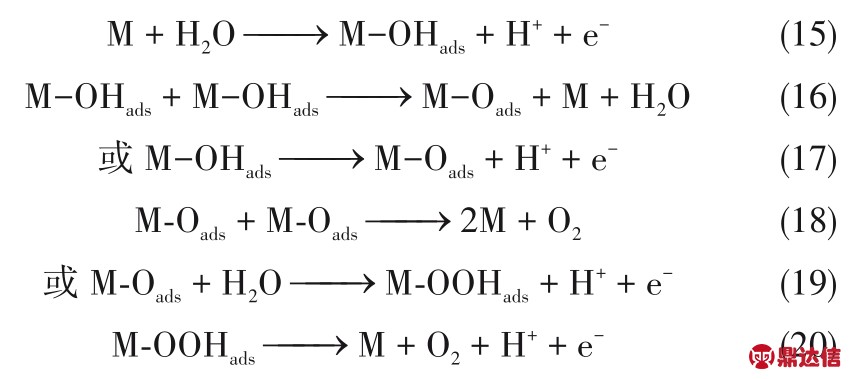
在酸性和中性介质中,H2O 分子首先吸附在催化剂表面。通过一个质电转移过程,OHabs将在催化剂表面形成,如式(15)所示。OHabs可能经历两种方式转变为Oabs。第一种是OHabs在催化剂的表面相互结合,形成Oads中间物种;第二种是发生第二次质电转移形成Oads。然后,吸附在催化剂表面的两个Oads中间物种可以相互结合直接释放O2分子。也有可能这些Oads中间物种还会与另一个H2O 分子发生反应,伴随第三次质电转移形成OOHads,最终吸附的OOHads失去第四个电子,分解生成O2。
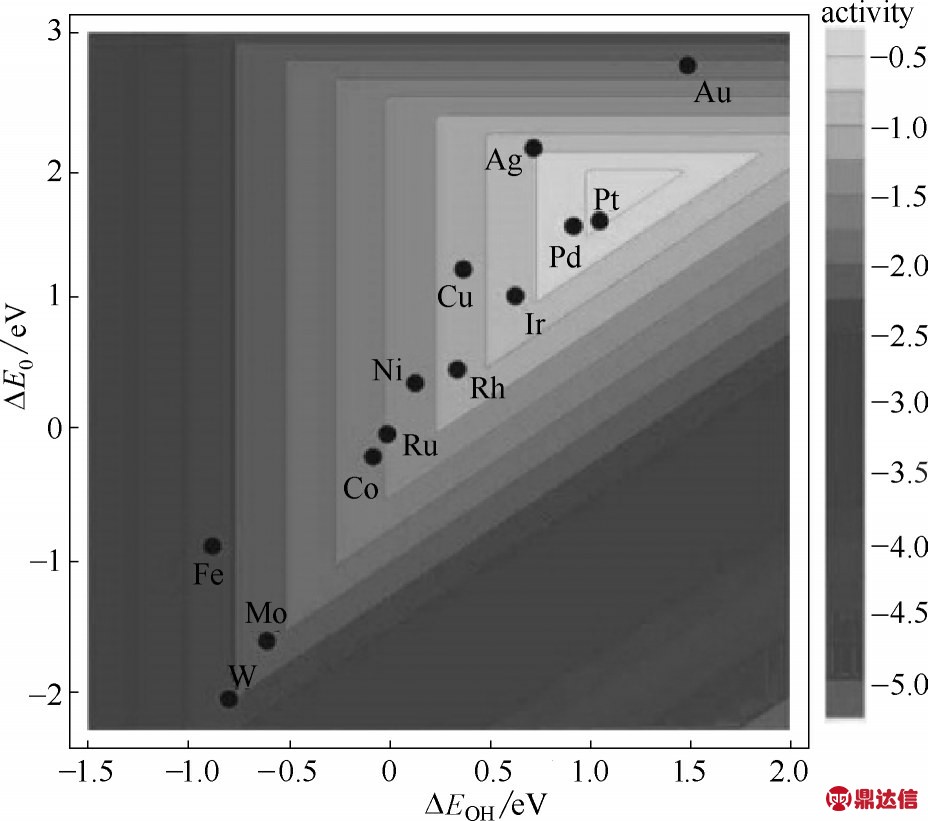
图1 过渡金属含氧物种结合能与催化ORR活性“火山图”[43]
Fig.1 Trends in oxygen reduction activity plotted as a function of both the oxygen and the hydroxyl group binding energy[43]

在碱性介质中,基元反应与在酸性介质中相似。碱性介质中的OH−会取代酸性介质中的H2O分子,首先吸附在催化剂表面。吸附的OHads随即可以与游离的OH−直接反应,在催化剂表面形成Oads。之后,在碱性介质中同样存在两条不同的产生O2的途径。
事实上,无论是在哪种介质中,Oads中间产物直接结合在一起产生O2都是非常困难的[44]。因此,一般认为,整个OER 过程遵循以下的反应过程:在酸性溶液中:式(15)→式(16) 或者式(17)→式(19)→式(20);在碱性溶液中:式(21)→式(22)→式(24)→式(25)。因此,OER 的过电位与中间物种(Oads、OHads和OOHads)的吸附状态密切相关。一般来说,OOH 的吸附自由能与OH 的吸附自由能呈线性关系。而O 和OH的吸附自由能差,即ΔG*O −ΔG*OH,被认为是一个催化剂OER 活性的描述符。因此,如图2 所示,ΔG*O −ΔG*OH 与OER 活性之间的火山型关系也被提出[45]。RuO2位于火山图的顶端,说明其具有最佳的OER催化能力。
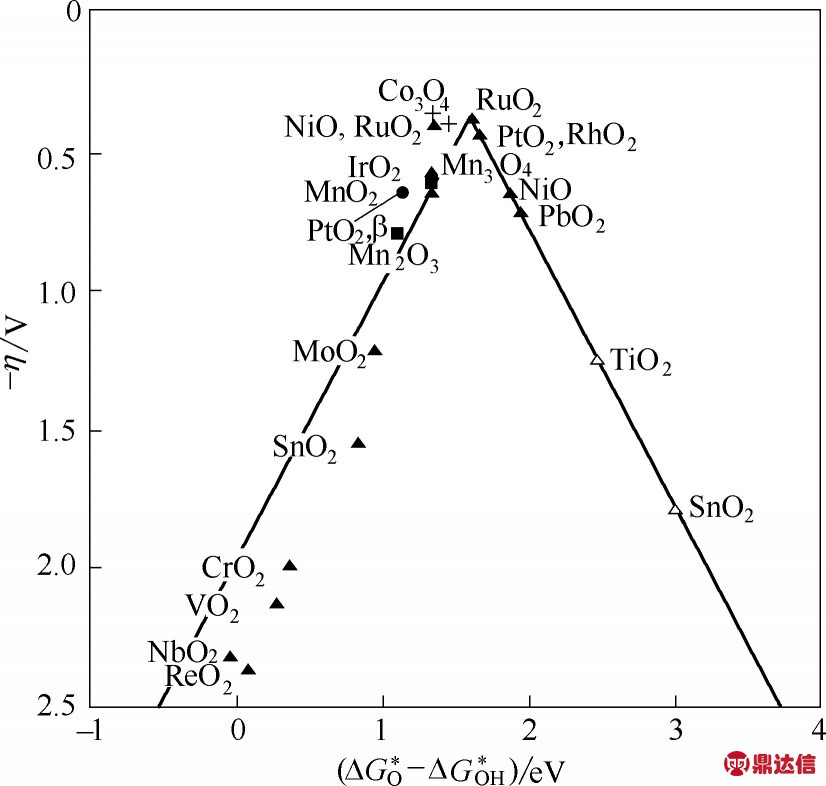
图2 析氧的活性趋势[45]
Fig.2 Trends in oxygen evolution activity plotted as a function of the difference between the binding energy of oxygen and the hydroxyl group[45]
2 氧电极反应的SACs研究进展
自2011年Zhang 等[46]首次提出SACs以来,SACs得到了广泛的关注,尤其是在电催化领域。对于电化学氧电极反应,大量的SACs表现出了非常好的催化能力,如表1~表3 所示。根据构成活性位点的不同金属元素种类,SACs 主要分为两类,分别为贵金属SACs 和非贵金属SACs。因此,在本节中,将分别从ORR、OER 反应出发,从上述两个方面详细展示SACs在氧电极催化剂方面取得的成就,并对氧还原和氧析出双功能催化剂的进展进行阐述。
2.1 ORR SACs
近年来,利用SACs 作为ORR 催化剂的研究工作得到了非常大的突破,也带来了更多的认识,如表1 所示。当催化剂粒径从纳米级缩放至原子级时,ORR 催化剂的催化机理和活性有了显著的变化。例如,纳米Pt颗粒常常被认为是最佳ORR催化剂,然而当Pt 以单原子形式作为催化活性位点时,其催化性能却不尽人意,更多的二电子反应过程被观察到[25,106]。相反,以非贵金属原子作为活性位点的氧还原SACs 却表现出更好的四电子ORR 催化活性[3,39]。因此,了解在ORR 中SACs 的应用对于发展高性能氧电极非常重要,故而本节总结了近年来SACs在ORR方面的研究进展。
表1 ORR SACs的研究现状
Table 1 Recent process of SACs for ORR
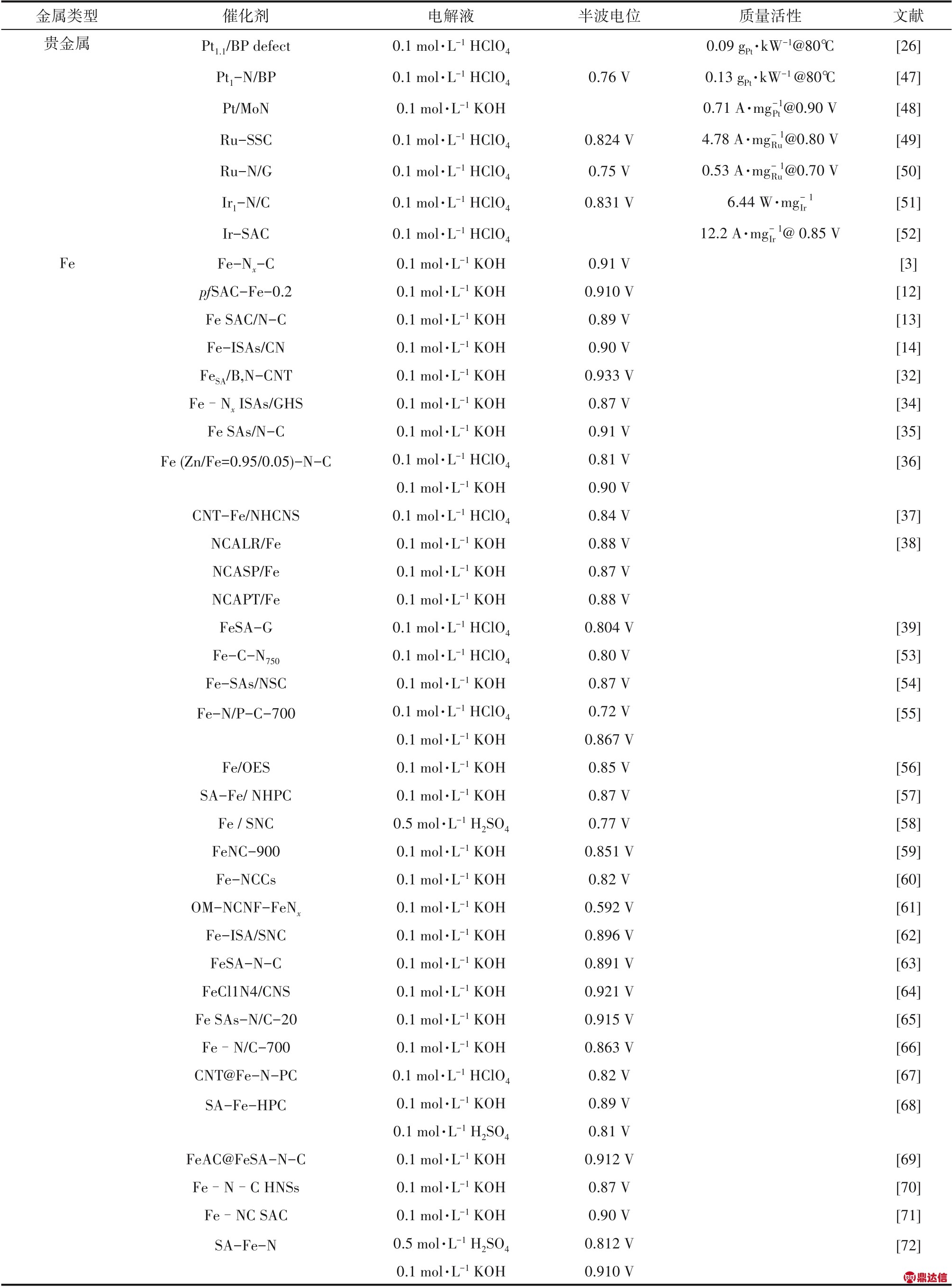
续表1
2.1.1 贵金属ORR SACs 为了降低贵金属的用量,诸如Pt、Ir 及Ru 等元素均被制备成SACs 用于催化ORR。Xu 等[26]采用富含缺陷的碳载体,利用其丰富的表面缺陷限制Pt 原子的团聚,成功地制备了Pt单原子纳米催化剂(Pt1.1/BP defect),该催化剂铂载量仅为1.1%(质量分数)。如图3(a)所示,以Pt1.1/BP defect 为阴极的酸性H2/O2单体电池在80℃时能够输出的最大功率密度为520 mW·cm−2,对应于0.09 gPt·kW−1的超高铂利用率,大大地提高了贵金属Pt 的利用率。进一步的理论计算表明,在该催化剂中被四个碳原子稳定锚定的单个Pt 原子(Pt−C4)发生ORR 过程需要的过电位最低,所以该位置被认为是其主要活性中心[图3(b)、(c)]。Ma等[48]研究了不同Mo 基载体对单原子Pt 催化活性位点的影响。他们发现在0.9 V(vs.RHE)的电位条件下,Pt 原子负载在α−MoC(Pt/MoC)是Pt 原子负载在MoN(Pt/MoN)的ORR 质量活性的十五分之一。理论计算表明,Pt/MoN 之所以具有如此好的ORR 催化活性,是因为Pt原子与载体中的氮原子相配位能够有效地降低Pt的d带中心,从而减弱其对OH*的吸附,说明了载体的配位环境对于SACs活性的影响非常重要。但是,即便如此,也并不是所有的单原子Pt 催化剂均表现出很好的ORR 催化性能。Lee 等制备了单原子Pt1/TiN催化剂[93]和Pt1/TiC催化剂[25]。如图3(d)、(e)所示,在催化ORR 的过程中,二者均表现出更为优越的二电子催化选择性,不利于其在FCs 中的使用。同时他们还发现,相比于Pt1/TiC,氧物种对Pt1/TiN 具有强亲和力,容易发生O—O 键的断裂。相反,Pt1/TiC能够阻止O—O 键断裂,因此对H2O2产生的选择性更高。所以TiC 载体比TiN 载体更适合于负载Pt 原子催化二电子ORR 过程,表明了SACs 中的载体不仅仅只作为锚定位锚定金属原子,还能积极参与表面反应。因此,在SACs 的设计过程中,载体表面结构的控制和设计对于其参与催化反应或控制影响单原子活性中心的电子结构有着重要的意义。
表2 OER SACs的研究现状
Table 2 Recent process of SACs for OER

表3 双功能SACs的研究现状
Table 3 Recent process of bi-functional SACs
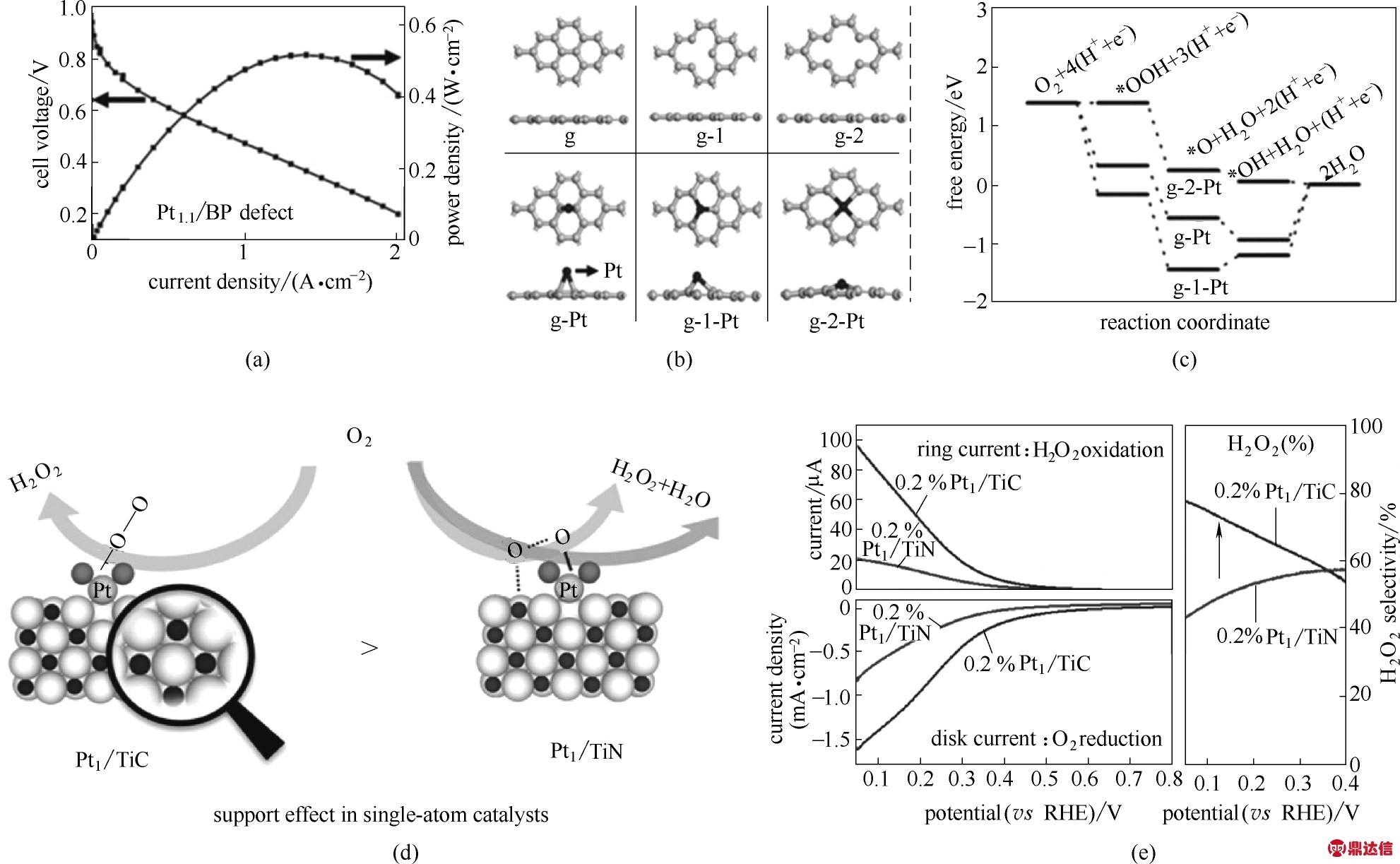
图3 采用Pt1.1/BP defect作为阴极的燃料电池极化曲线及功率曲线(a);不同结构的载体负载单原子Pt的结构模拟图(b);在0.83 V(vs.RHE)催化ORR的Gibbs自由能曲线(c)[26];Pt1/TiC,Pt1/TiN模拟图(d);两种催化剂的ORR极化曲线及H2O2选择性曲线(e)[25]
Fig.3 Polarization and power density curves of an acidic H2/O2 fuel cell with Pt1.1/BP defect as the cathode(a);Optimized structures(b)and free energy diagram(c)for ORR at 0.83 V(vs.RHE)of the different model for single Pt atom supported on monovacancy graphene(g−1−Pt,Pt−C3),single Pt atom supported on divacancy graphene(g−2−Pt,Pt−C4);the support effect in Pt1/TiC and Pt1/TiN catalysts(d);oxygen reduction reaction polarization curves on single atom Pt:ring currents,ORR polarization curves,H2O2 selectivity calculated from disk and ring currents(e)
其他非铂贵金属如Ir、Ru 也作为SCAs 的活性中心被用于ORR[48,52]。Tour等[50]通过对含Ru的氧化石墨烯(GO)前体在NH3气氛下退火,成功地在氮掺杂石墨烯上合成了原子分散的Ru。该催化剂在酸性介质中表现出了出色的四电子ORR 活性。在0.1 mol·L−1 HClO4中,起始电位和半波电位分别为0.89 V 和0.75 V。同样地,理论计算研究发现,Ru−oxo−N4结构被认为是与ORR 催化活性直接相关的活性中心。最近,Xing 等[49]通过实验加计算证明了RuN4OH 作为活性位点比RuN4 具有更加优异的ORR 催化活性。在RuN4OH 活性位点上,明显观察到了d 带中心的下降,从−2.03 eV(RuN4)到−3.22 eV(RuN4OH),使得其对OH*的吸附能力减弱,有利于生成物种的脱附,使其具有非常好的催化活性。因此,合成的单原子Ru催化剂表现出了优于Pt/C催化剂的活性。同样地,单原子Ir 催化剂也被合成并运用于ORR 中,被开发的Ir−SAC 具有非常高的质量活性[12.2 A·mg−1,@0.85 V(以Ir 质量计)],比铱纳米颗粒表现出更高的数量级,证明了其在FCs 中的可实用性。而其高活性也被证实归因于反应中间体在具有四个氮原子位点的单原子Ir(Ir−N4)上的适度吸附能[52]。类似于Pt 基SACs,其他贵金属SACs也被观察到有利于ORR 二电子反应的发生。Joo等[106]研究了一系列负载在碳纳米管上的贵金属SACs,他们发现这些催化剂都有利于二电子反应的发生。其中除Pt 之外,单原子Ru 催化剂的H2O2产生最多,说明其最有利于催化二电子反应的进行。计算发现之所以能够催化二电子反应,与其强OOH*和O*物种的吸附能有关。因此,对于这些贵金属SACs而言,同样也面临如何调整载体表面结构以改善单原子位点电子结构使之有利于四电子反应过程的问题。而且这些贵金属SACs 相比于Pt 基催化剂氧还原催化活性偏低,因此其活性仍然具有较大提升空间。
2.1.2 非贵金属ORR SACs 对于非贵金属纳米颗粒而言,其ORR 催化活性普遍较低,且存在实际工作条件下稳定性差等短板,严重限制了其发展和实际应用。而SACs 的出现给予了非贵金属ORR 催化剂新的机遇。因此,出于催化剂性能和成本的双重考虑,人们对于以非贵金属为活性位点的SACs也进行了广泛的研究,并得到了以Fe、Co 为代表的一系列高性能非贵金属ORR SACs[34−36]。
(1)Fe ORR SACs 众所周知,在碳材料中,由电负性较强的氮原子与金属原子配位形成M−Nx结构,被认为是良好的ORR 催化活性中心[7]。因此,许多基于单分散M−Nx位点的碳基SACs被大量开发与利用。其中具有单分散结构的Fe−Nx催化剂成为了研究的重点。沸石咪唑酯骨架结构材料(ZIF)具有独特的M−Nx结构,可以有效地抑制金属原子的迁移和聚集,是合成碳基SACs 的常用的前体。如图4(a)所示,Sun 等[3]通过将Fe−Phen 配合物浸入ZIF−8 骨架的纳米笼中,然后在惰性气氛下热解,制得了具有Fe−Nx结构的单原子铁催化剂(Fe−Nx−C)。所获得的Fe−Nx−C 表现出优异的ORR 电催化活性,其起始电位达1.05 V,半波电位为0.91 V。采用其作为锌−空气电池(ZABs)的阴极催化剂时,电池显示出高的开路电位(1.51 V)以及高的功率密度(96.4 mW·cm−2),并且表现出了良好的稳定性。同时,采用该催化剂制备的柔性全固态ZABs,也被观察到了高达1.49 V的开路电位及120 h的长循环寿命,说明其具有非常好的实用性能。最近,为了进一步降低铁原子的团聚的可能性,Yang 等[53]开发了一种控制合成Cd 基ZIF 用于降低SACs 合成过程所需温度的方法。他们利用Cd 取代Zn,由于Cd 的沸点远低于Zn,所以可以有效地将SACs 的合成温度从1000℃(用于去除残余金属Zn)降低至750℃。所得的Fe基SACs 在组装到H2/O2 燃料电池中后可以提供680 mW·cm−2的最大功率密度。
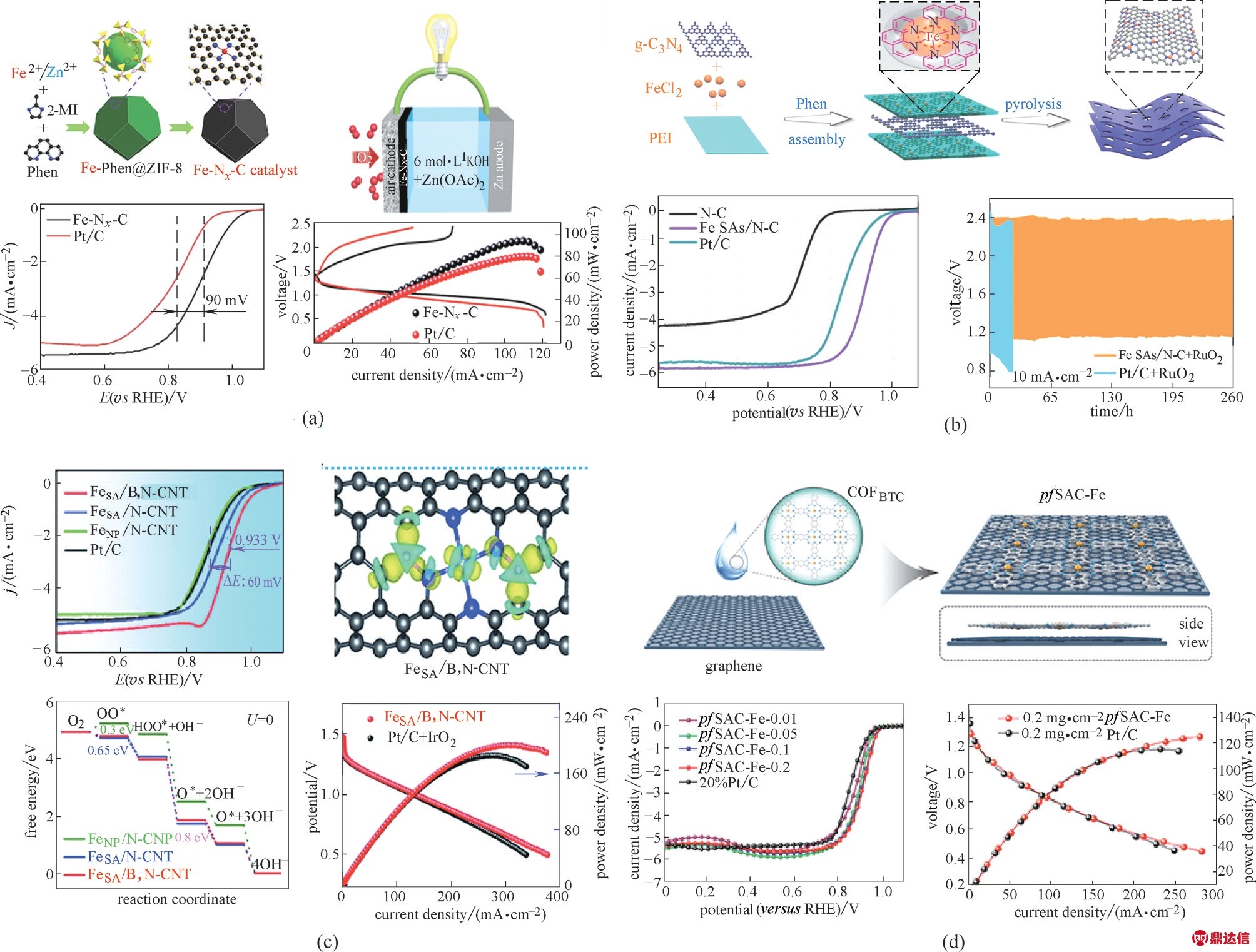
图4 Fe−Nx−C的合成过程示意图,ORR极化曲线和锌空电池放电极化曲线以及相应的功率密度图(a)[3];Fe SAs/N−C 的合成示意图,碱性条件下LSV曲线和以Fe SAs/NC、Pt/C为阴极催化剂在锌空电池中的充放电循环曲线(b)[35];FeSA/B,N−CNT的ORR极化曲线,B掺杂的FeN4模型的d带中心的DFT模拟,自由能图和锌空电池放电极化曲线以及相应的功率密度图(c)[32];pfSAC−Fe催化剂的合成路线,LSV曲线和使用Pt/C和pfSAC−Fe−0.2作为催化剂的锌空电池极化和功率密度曲线比较(d)[12]
Fig.4 Schematic illustration for the synthetic procedure,ORR polarization curves,discharging polarization curves and corresponding power density plots of zinc–air batteries for Fe−Nx−C(a)[3];Schematic illustration for the synthetic procedure,ORR polarization curves in 0.1 mol·L−1 KOH and cycling performance Zn–air batteries of Fe SAs/N–C sample(b)[35];ORR polarization curves,DFT calculations of the modified d−band center,the free−energy landscape,discharge polarization curves and the corresponding power density plots of zinc–air batteries for B−doped FeN4 models(c)[32];Synthesis,ORR performance and Zn−air batteries performance of pfSAC−Fe(d)[12]
除ZIF 外,其他具有明确M−Nx结构的材料,如金属酞菁,也被认为是合成碳基SACs 的良好的前体。Tang 等[34]以Fe 酞菁(FePc)作为前体,合成了具有空心纳米球结构的铁基SACs(Fe ISAs/GHSs)。FePc 分子的刚性平面大环结构和石墨烯纳米球的表面的不饱和效应被认为是Fe−Nx物种单分散的原因。原子分散的Fe 活性位点外加中空结构为该催化剂提供了丰富的可接触活性位点,因此其表现出了出色的ORR 性能。C3N4也可以被作为前体用于合成铁基SACs。Wu 等[35]利用C3N4通过多功能分子限制的热解策略,成功地制备出了具有单分散Fe−Nx结构的SACs 催化剂(Fe SAs/N−C)。该催化剂具有非常良好的多孔结构(比表面积高达1097 m2·g−1)以及较高的金属载量(质量分数3.5%)。如图4(b)所示,在0.1 mol·L−1 KOH 的条件下,该催化剂的半波电势相对于RHE 为0.91 V。在更具挑战性的酸性溶液中,Fe SAs/N−C 催化剂仍具有良好的ORR 活性,与商业Pt/C 催化剂相当。同时,Fe SAs/N−C 在碱性和酸性介质中均显示出极高的稳定性。当其组装进入ZABs 中时,电池表现出相比于采用贵金属催化剂更为优异的循环性能,说明了该SACs具有代替贵金属的能力。
近年来,有不少研究使用生物质前体进行了铁基ORR SACs 研究,并取得了出色的成果[38,57,59]。该类方法综合考虑了环保性,具有可持续性,是当前发展SACs 的一个重要方向。Tang 等[70]使用廉价的组氨酸生物质材料(His)作为N 和C 来源,采用SiO2作为模板合成了具有中空纳米碳球结构的铁基SACs(Fe−N−C HNSs)。凭借众多原子分散的Fe–N4结构以及其独特的纳米中空结构,Fe−N−C HNSs在碱性介质中表现出出色的ORR 性能,其起始电位及半波电位分别为1.046 V 和0.87 V,均优于Pt/C 催化剂。Wang 等[57]提出采用生物质衍生的氮掺杂的多孔碳负载单原子Fe。与分子血红素和纳米Fe 样品相比,所制备的铁基SACs表现了优异的催化活性(E1/2=0.87 V,Jk@0.88V=4.1 mA·cm−2)。Hu等[59]通过对富含血红蛋白细胞的动物血液进行直接热解,开发了一种单原子Fe−N−C 电催化剂。他们发现热解温度显著影响Fe−Nx配位点的状态,从而影响催化性能。Fe−Nx位点可以在900℃下有效地形成,而高温会导致Fe−Nx位点的破坏和Fe原子的聚集。因此,合理地选择生物质前体以及控制合成条件对于SACs的合成至关重要。
对于铁基SACs,虽然其催化活性已经得到了突破,但是还有进一步提升的空间。目前,调节单原子活性位点的电子结构被认为是最佳的方式之一[32,58,69]。Xiong 等[32]通过硼掺杂优化单原子Fe 活性位点的d 带中心,从而改善其上含氧物种的吸附动力学,提高ORR性能。如图4(c)所示,经过优化的催化剂在0.1 mol·L−1 KOH 介质中的性能优于纯Fe−N−C 和商业Pt/C 催化剂,其半波电势为0.933 V(vs.RHE)。理论表明,B 掺杂后金属位点上的价电子增加,磁矩减少,使得金属位点的d 带中心下移,从而调整了其对含氧物种的吸附能,大大地提高了ORR性能。Guo等[58]通过模板牺牲法获得了硫掺杂的Fe/N/C 催化剂(Fe/SNC)。经过S 元素掺杂后,Fe 位点附近的电子分布被有效调整,从而改善了与含氧物种的相互作用,提升了ORR 催化活性。由于这些协同作用,Fe/SNC 催化剂在0.5 mol·L−1 H2SO4中比无硫单原子催化剂(Fe/NC)表现出更好的ORR 活性。P 元素同样被证明能够调控铁基SACs 的电子结构。Yuan 等[55]发现P 掺杂形成的Fe−N3P 活性中心具有更加优异的催化活性。所以,多元素掺杂的方式可能可以为铁基SACs提供新的发展方向,也为了解活性中心的催化机制和设计催化剂提供了新的思路。
上述所列举的铁基SACs 的合成方法大部分为热解法,即选取满足需求的前体物质,辅以合适的模板物质,经过热解和一系列的后处理从而获得催化剂。但是,常用的高温处理总是会导致不可预测的结构变化和随机产生的单原子配位结构,影响催化剂的精准设计制备。因此,开发更为精准控制的铁基SACs 非常重要。Xiang 等[12]成功采用无热解的合成方法,使用alpha−共轭酞菁铁(FePc)−有机骨架(COF)制备了具有高电催化活性的SACs。如图4(d)所示,Xiang等[12]没有通过热解而是通过COF网络和石墨烯基质之间的分子间相互作用来锚定原子,获得了具有Fe−Nx活性中心的催化剂。与Pt/C 催化剂相比,合成后的催化剂表现出了出色的催化活性。在0.85 V(vs. RHE)下的动力学电流密度(Jk)为25.86 mA·cm−2,是Pt/C 催化剂(6.49 mA·cm−2)的4倍。该催化剂还在ZABs 中具有出色的功率密度和循环稳定性。这为更加可控地制备铁基SACs 提供了一条全新的道路。然而,此类无热解方法的合成开发策略依然很少,还需要进一步探索。
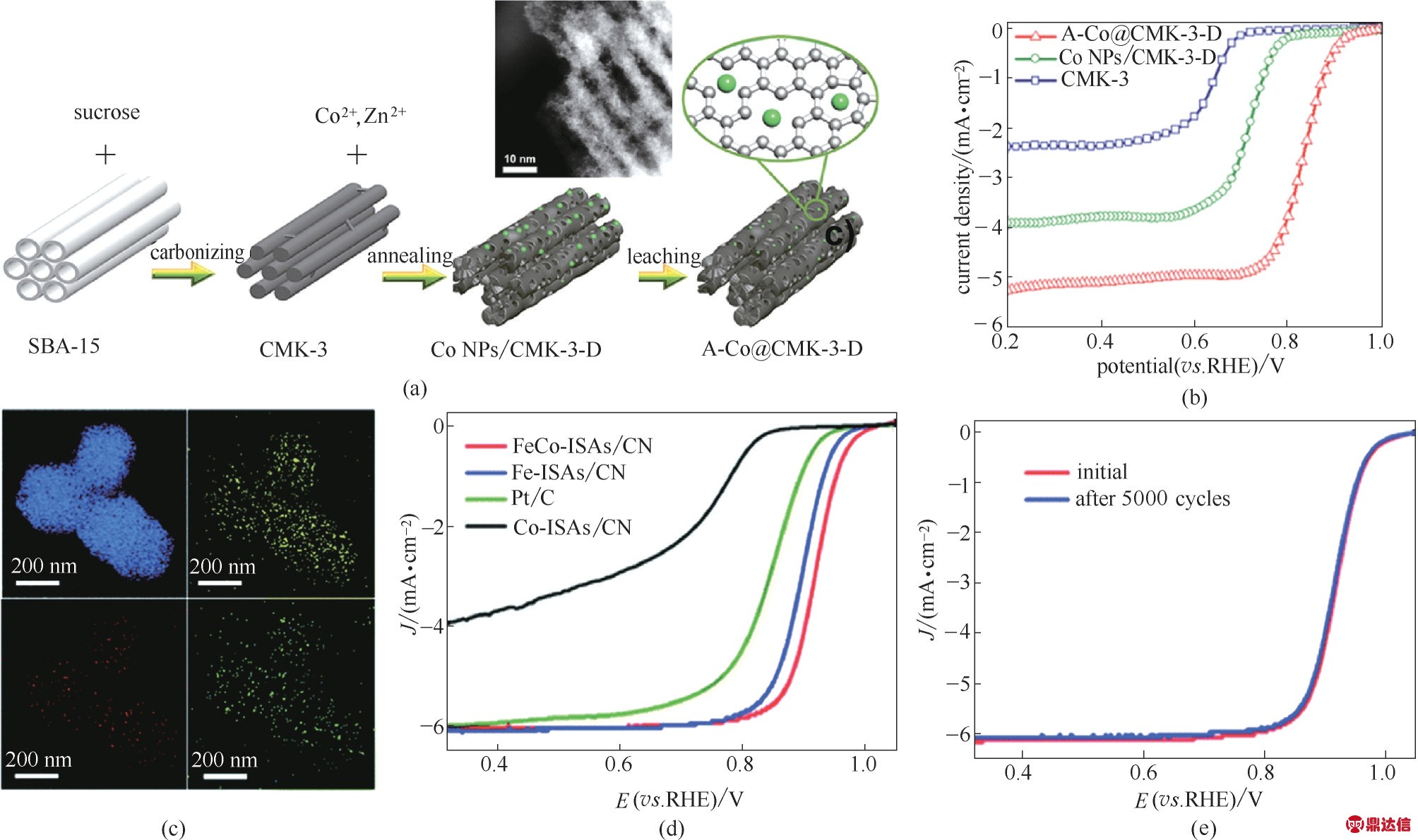
(2) Co ORR SACs 与铁基SACs 类似,钴基SACs大多也是通过高温热解法,利用具有固有缺陷的碳材料,并辅以氮掺杂来完成制备。因此,其在高温热解过程也会出现颗粒团聚并被包覆的现象,从而使得鉴定其主要活性结构也极为困难。针对这一情况,Liang 等[2]报道了一种低温NH4Cl 处理策略,可以有效地从Co−N−C 催化剂中腐蚀掉石墨烯包封的纳米颗粒,而不会破坏共存的原子分散的Co−Nx位点。经过处理,催化剂中的大颗粒明显减少,催化剂的催化活性大大提高,说明了单分散的Co−Nx才是该催化剂中的真正活性中心。该方法还在单原子铁、单原子镍方面得到了证实。无独有偶,Mai 等[9]也通过相当低的温度(300~400℃)下的NH3热处理成功地在掺氮石墨烯上负载了高载量的单原子钴(质量分数12.8%)。该催化剂对ORR 具有出色的电催化性能。当用作ZABs 的空气催化剂时,实现了1.40 V 的高开路电压和出色的功率密度[9]。这说明NH3热处理能够腐蚀碳材料以便纳米颗粒的去除,同时还能在碳骨架上掺杂更多的氮或者形成更多的缺陷位点以捕捉金属原子形成单原子活性位点。如图5(a)所示,Jia等[8]利用具有丰富缺陷的介孔碳材料合成了钴基SACs(A−Co@CMK−3−D)。所获得的催化剂在碱性电解质中,半波电位为0.835 V(vs. RHE),表现出可与Pt/C 催化剂相当的ORR 催化性能[图5(b)]。同时以该催化剂为空气电极的ZABs 也具有优秀的放电和充电性能以及45 h的长期稳定性。钴基SACs 不仅仅在实验方面取得了非常大的进展,人们也在理论研究方面证实了钴单原子活性中心对ORR 有积极的催化作用。Lou等[5]利用DFT 计算明确了合成单原子催化剂Co@MCM 的原子结构及其对ORR 电催化性能的影响。他们发现该催化剂具有的优异ORR 活性归因于以下两个原因:(1)由孤立的Co 原子修饰引起的电荷再分布改善了O2的吸附和还原效率;(2)最大程度暴露活性中心从而充分保证便捷的传质过程也是另一个重要原因。

图5 A−Co@CMK−3−D的合成示意图及HADDF−STEM 图(a);Co NPs/CMK−3−D,A−Co@CMK−3−D 以及CMK−3催化剂的ORR极化曲线(b)[8];FeCo−ISAs/CN 的元素分布图(c);Fe−ISAs/CN,Co−ISAs/CN,FeCo−ISAs/CN 以及Pt/C催化剂的ORR极化曲线(d);FeCo−ISAs/CN 催化剂在5000次循环前后的ORR极化曲线(e)[6]
Fig.5 Schematic illustration of the synthetic procedure and the HADDF−STEM images of A−Co@CMK−3−D(a);ORR polarization curves of Co NPs/CMK−3−D,A−Co@CMK−3−D and CMK−3 catalysts(b)[8];EDX elemental mappings of FeCo−ISAs/CN(c);ORR polarization curves of Fe−ISAs/CN,Co−ISAs/CN,FeCo−ISAs/CN and Pt/C catalyst(d);Durability test of FeCo−ISAs/CN(e)[6]
对于钴基SACs,通过掺杂其他金属元素协同提高催化剂的活性也被提出用以进一步提升催化活性。Li 等[6]通过吸附−煅烧策略成功地制备了金属−有机骨架衍生的氮掺杂碳上Fe 和Co 的单原子催化剂(FeCo−ISAs/CN)。如 图5(c)~(e)所 示,所 得 的FeCo−ISAs/CN 相比于单种元素掺杂的催化剂,表现出更高的催化反应活性,其半波电位高达0.920 V,说明单原子Co 还可以进一步调节Fe 基单原子催化剂的活性,为进一步构建高效ORR 催化剂提供了方向。此外,该催化剂在5000 次循环过程中,ORR 活性衰减非常低,说明其还具有良好的稳定性。Wang等[7]通过简便的无热解一步球磨法制备了具有超薄共轭层(约3.5 nm)和高密度单金属原子位点(质量分数10.7%,0.73 个金属原子/nm2)的二维共轭芳族网络(CAN)。制备的具有双元素的CAN−Pc(Fe/Co)显示出最为出色的ORR 质量活性,为47 mA·mg−1cat.,分别比商业Pt/C 中的Pt 和Pt/C 高1.3 倍和6.4 倍。此外,以CAN 作为空气电极构造的ZABs,其质量/体积功率密度为880 W·g−1cat./615 W·cm−3cat.,并且可以长期稳定运行100 h,说明该催化剂具有代替贵金属催化剂的能力。因此,如果能够很好地利用多种元素之间的协同作用构建多元素单原子催化剂,可能会实现ORR催化活性及稳定性的巨大提升。
为了设计出具有优异性能的氧电极SACs 催化剂,理解氧电极表面的反应机理非常重要。如前所述,氧电极上所发生的反应包括ORR 和OER。因此,在本节中,将简要阐述ORR 和OER 的基本反应机制。
Xing 等[21]制备了用于ORR 的Cr 基SACs(Cr/N/C),其中原子分散的Cr被证实具有Cr−N4配位结构。如图6(a)所示,制得的Cr/N/C−950 催化剂最佳半波电位为0.773 V,并表现出良好的稳定性。研究表明其稳定性得到的提升均归因于Fenton 反应的减少,这为规避铁基ORR 催化剂的稳定性差问题提供了新的可能性。Wei 等[84]报道,只需采用平均1(°)·min−1的低退火速率,就可以成功制备含超高Zn含量(质量分数9.33%)的Zn−N−C 催化剂。该催化剂具有可观的ORR 活性,且无论在酸性或者碱性介质中,其ORR 稳定性均明显优于Fe−N−C 催化剂。进一步的实验和DFT计算表明,在酸性介质中,Zn−N−C催化剂比相应的Fe−N−C催化剂更不易质子化,因此Zn−N4结构在使用过程中比Fe−N4结构更加稳定。Zhao 等[24]报道了一种基于单原子钨的ORR 催化剂。该催化剂基于具有可控配位结构的单原子钨−氮−碳配合物,通过在700~750℃范围内热解还原所得。该催化剂在0.1 mol·L−1 KOH 下具有优秀的ORR 催化活性,初始电位约为1.01 V,半波电位达0.88 V;在0.1 mol·L−1 HClO4中同样也表现出了良好的ORR催化活性,其起始电位为0.87 V,半波电位为0.77 V。更重要的是,该复合催化剂可提供0.63 A/mg@0.9 V 的质量活性,比商业Pt/C 催化剂的活性高出约5.7 倍,也超过了先前报道的所有钨基ORR 催化剂的值。
铜基ORR SACs 同样也被认为是铁基ORR SACs 的良好替代物。Li 等[85]利用金属颗粒释放原子并借助氨形成挥发性的Cu(NH3)x物质,最终将其捕获在富氮多孔碳上获得铜基SACs。该方法易于放大,对于在工业水平上生产功能性SACs具有指导意义。所得的催化剂也显示出卓越的ORR 催化性能(0.1 mol·L−1 KOH 下E1/2=0.895 V)以及稳定性,揭示了高性能铜基ORR SACs 的广阔发展前景。在探索提升稳定性、提高催化剂性能的同时,为获得更多的催化活性位点,高载量也成为探索目标之一。Baek 等[86]报告了一种高Cu 载量的SACs(Cu−N−C),其Cu含量超过20.9%(质量分数)。如图6(b)所示,在0.85 V(vs.RHE)的电势下,单原子Cu 的质量活性比金属Cu纳米颗粒高54倍以上。
目前,虽然非常多的非贵金属SACs 用于ORR被开发研究,但是其活性在实际运用时仍然难以满足要求。如何进一步提高这些催化剂的活性,还需要投入更多的精力。同时,深入了解催化活性中心的催化机制对如何设计催化剂以提高催化活性也非常重要。
2.2 OER SACs
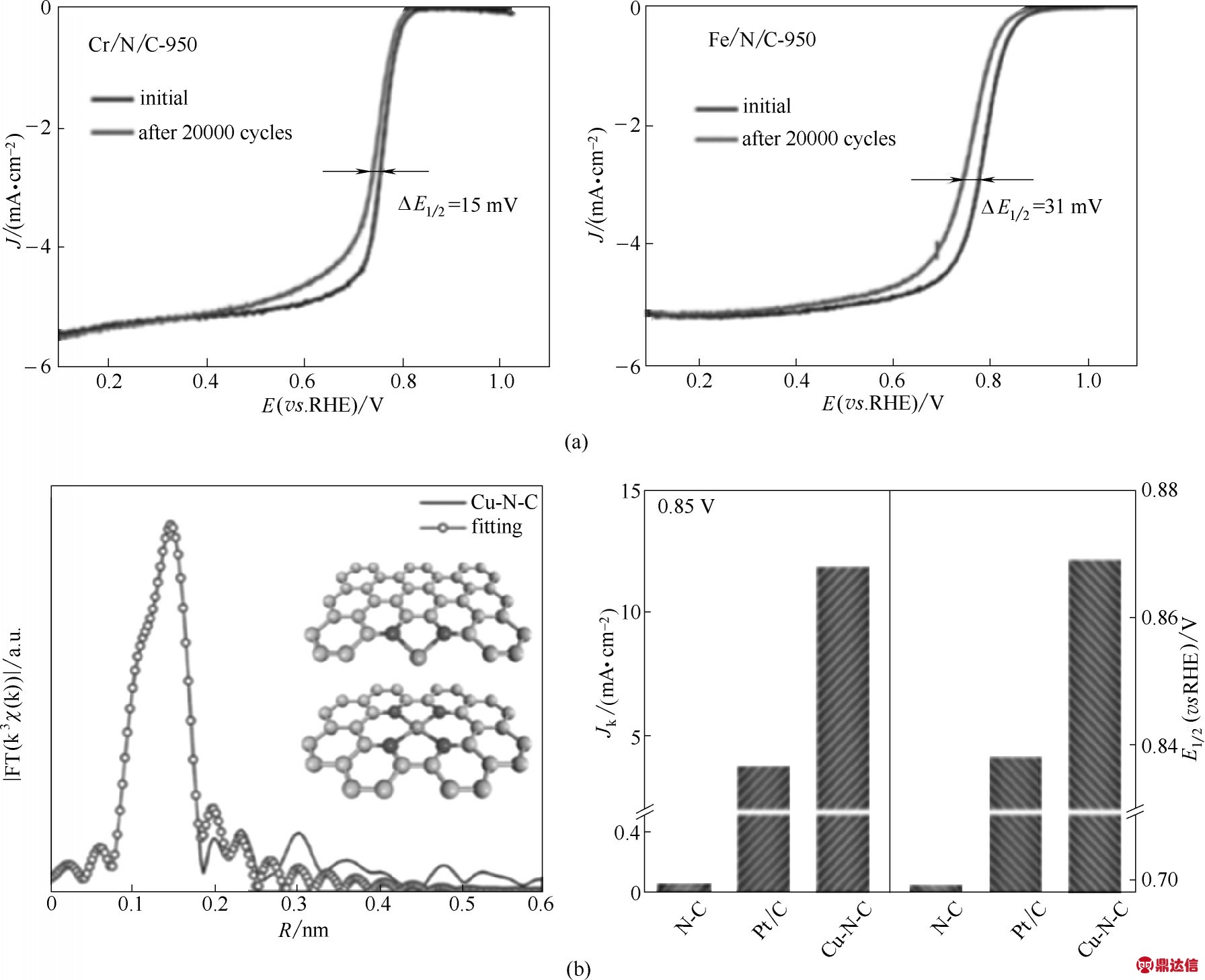
图6 Cr/N/C−950的极化曲线(与Fe/N/C−950比较)(a)[21];Cu−N−C的EXAFS谱和Cu−N−C,N−C和Pt/C催化剂的动力学电流(0.85 V时)和半波电位(b)[86]
Fig.6 Comparison of the polarization curves of Cr/N/C−950 and Fe/N/C−950 initially and after an accelerated degradation test over 20000 cycles(a)[21];EXAFS fitting curve of Cu−N−C and kinetic currents(at 0.85 V)and half−wave potentials for Cu−N−C,N−C and Pt/C(b)[86]
对于OER,目前RuO2和IrO2被认为是活性最好的OER 催化剂。但是,它们仍然需要较高的阳极过电位才能驱动10 mA·cm−2的电流密度。同时,在使用钌基催化剂(特别是RuO2)催化OER的过程中,催化剂易在高电位下出现过度氧化,使得晶格塌陷。这导致所谓的晶格氧逸出反应,并伴随着部分Ru原子从阳极剥落,意味着催化剂稳定性的下降和OER活性的丧失。因此,提高RuO2催化剂稳定性成为研究重点之一。将Ru 以单原子的形式嵌入到载体的晶格中被认为不仅能够提高Ru金属的利用率,还能大大提高其在使用时的稳定性。Li等[28]报道可通过压缩应变效应在PtCu 合金载体上成功实现Ru 的单原子分散。单原子分散的Ru 不仅可作为活性位点催化OER,而且由于压缩应变效应的作用,Ru 的电子结构被调制,使得其具有非常好的OER 动力学。最为重要的是,采用该方法还能够极大地减轻Ru基电催化剂在酸性电解质中的降解问题。最后,他们还通过酸蚀刻和电化学浸出等手段,得到了使用不同的PtCu 合金载体构造的一系列Ru 基SACs,并发现了OER 活性和PtCu 合金的晶格常数之间的火山关系。其中,性能最好的催化剂Ru1−Pt3Cu 达到10 mA·cm−2的电流密度的过电位仅为220 mV,其使用寿命也比商业化的RuO2提高了一个数量级。Sun等[29]也制备了稳定锚固在钴铁层状双氢氧化物表面的单原子Ru 催化剂。Ru 负载量仅为0.45%时,合成的催化剂对OER 依然表现出了出色的催化活性,达到10 mA·cm−2 的电流密度的对应过电位为198 mV,且Tafel 斜率仅为39 mV·dec−1。X 射线吸收光谱表明由于Ru 原子与层状双氢氧化物之间的强耦合电子作用,分离的单原子Ru即使在高过电势下也保持在低于+4 价的氧化态,使得该催化剂具有优异的电催化活性和稳定性。除了Ru以外,人们也对低载量、高原子分散度、高性能的Ir基催化剂进行了一系列探索。如图7(a)、(b)所示,Wang等[27]提出了一种原子限域合金化的方法来合成Ir 基单原子催化剂(单原子Ir@Co 纳米片)。该催化剂上Ir原子的载量约为1.7%。当催化OER时,该催化剂具有低过电位(10 mA·cm−2下为273 mV)以及高稳定性。计算研究表明,发生在该催化剂表面的水氧化反应是通过双核串联机制进行的,Ir−Co 双位点协同促进了OER 的发生。除了负载在合金上面,将Ir 单原子负载到化合物上也被报道具有非常优异的催化活性以及稳定性。Tan 等[89]制成了Ir/NiFeP 催化电极,其中Ir以单原子的形式被负载在金属磷化物上。通过电化学氧化后,由于表面重构,在Ir/NiFeP 表面原位转化形成了一层Ir/NiFeO。因此,最后获得的Ir 基SACs 具有非常杰出的催化性能,仅仅需要250 mV的过电位就能产生300 mA·cm−2的析氧电流。原位观测和计算表明,Ir 单原子在催化OER 的过程中,其表面形成的Ir−O 位点有效地促进了OOH*中间体的形成。同时,在OER 过程中,孤立的Ir原子和(氧)氢氧化物之间的强电子相互作用使得其具有更为稳定的表面结构,从而使该催化剂具有非常好的稳定性。其他的贵金属,如Pt、Au等元素,同样也被用于合成单原子催化剂[17,92−94]。但实际上,即便降低贵金属的用量可以降低催化剂的成本,但是由于其不可避免的高昂的价格以及其资源的稀缺性,开发非贵金属OER SACs仍然极为重要。
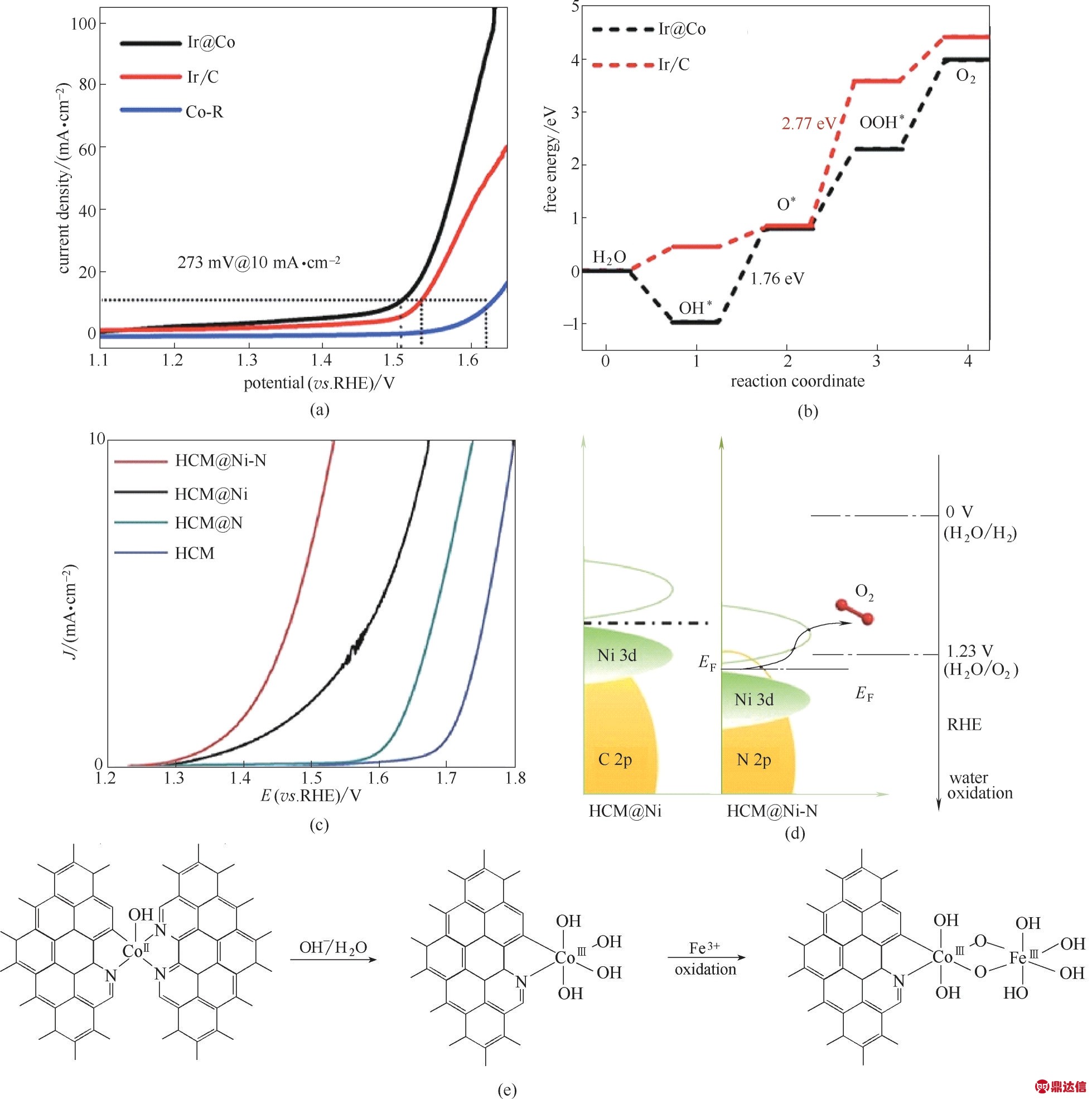
图7 Ir@Co的析氧LSV曲线(a);Ir@Co纳米片模型上的OER进程(b)[27];HCM@Ni−N的LSV曲线(c);氮掺杂前后催化剂的能带变化(d)[42];Co−Fe双原子催化剂形成模型(e)[10]
Fig.7 LSV curves for Ir@Co,Co−R and Ir/C in 1 mol·L−1 KOH solution(a)and the OER processes on the Ir@Co nanosheet model(b)[27];LSV curves of HCM@Ni,HCM@Ni−N,and Ni foil(c);Schematic band diagrams of HCM@Ni and HCM@Ni−N(d)[42];proposed model for the formation of Co−Fe double−atom catalyst(e)[10]
因此,大量的基于非贵金属的SACs被开发用于OER 之中。对于OER,非贵金属SACs 以Ni、Co、Fe三种过渡金属作为主要活性位元素。Duan 等[99]报道了一种利用氧化石墨烯制备3d过渡金属单原子−氮掺杂石墨烯框架(M−NHGFs)的方法,成功地合成了一系列具有不同金属单原子的M−NHGFs。他们发现,MN4C4结构决定了这些催化剂的OER 催化活性。电化学测试证实了该类催化剂的OER 活性符合Ni>Co>Fe 的规律。密度泛函理论预测进一步证明了M−NHGFs 之间活性的差异是由于金属元素的d轨道电子数的不同所造成的。在MN4C4结构中,随金属元素的d 电子数的增加,中间产物的吸附自由能发生变化,同时还带来了反应途径的变化。与Co−NHGFs 和Fe−NHGFs 的单活性位点反应机制相比,在Ni−NHGFs 催化OER 反应可以通过双活性位点反应机制进行,且该途径的反应能垒为0.42 eV,远远低于其他金属单原子催化剂,表明了SACs的催化性质取决于金属中心的自身性质及其配位构型的相互作用。Lou 等[42]成功地合成了一种用于OER的Ni 基SAC(HCM@Ni−N)。EXAFS 和XANES 研究表明,HCM@Ni−N 中孤立的Ni 中心具有不饱和的Ni−N 键。DFT 计算表明,该不饱和的Ni−N 配位结构能够有效地使费米能级向下移动从而降低中间体的吸附能[图7(c)、(d)],进而促进OER 动力学。因此,该催化剂显示出了高的OER 性能(304 mV@10 mA·cm−2)以及优异的稳定性。
尽管单金属元素(例如Fe、Co 等)的SACs 已被广泛开发用于催化OER,但是其性能依然具有很大的发展空间。因此,研究者同样也探索采用双元素位点来获得更为良好的OER 催化活性。Hu 等[40]提出了利用DPA 包覆MOFs 的方法引入两种元素,然后热解合成了具有原子分散的Co−Ni双位点的氮掺杂空心碳NCs。合成的二元催化剂相比于单种元素的催化剂,具有更为优异的OER 催化活性。实验和理论研究共同表明,该催化剂中的二元金属活性位点之间的协同作用能够有效地降低反应能垒从而加快反应动力学,达到增强电催化活性的目的。同样地,通过单原子Co 催化剂转化获得的Co−Fe 双元素单原子催化剂也表现出了更好的催化活性。在此过程中,Fe 原子可以通过桥接一个或两个OH,与原子分散的Co−N−C 结合形成Co−Fe 双元素单原子催化剂[图7(e)]。因此,该催化剂表现出与金属氧化物相似的OER催化能力[10]。
目前,在OER 催化中,贵金属、非贵金属的SACs 研究已经得到了一些可喜的成果。但实际应用对这些催化剂的活性也提出了更高的要求。因此,如何在深入理解催化中心的催化机制的基础上,设计更高活性、更广应用范围的SACs,是单原子OER催化剂发展需要重点关注的问题。
2.3 双功能SACs
对于氧电极来说,同时具有优越ORR、OER 性能的双功能催化剂将成为最佳选择。事实上,大多数SACs 均具有多种电催化活性,包括而不仅限于ORR 和OER。但是,电催化剂对不同反应过程的催化活性有区别。例如,部分催化剂的ORR 催化性能非常优越,但是OER 性能不佳;而有的则刚好相反。因此,利用双功能催化剂的特征量超电势ΔE,即在10 mA·cm−2的OER 过电位与ORR 的半波电位之差,可以判断双功能催化剂的综合性能,如表3 所示。而如何开发同时具有优越ORR、OER 性能的双功能催化剂以投入实际ZABs 的应用,也成为一个研究热点。利用和以上两种类别的催化剂相似的开发方法,对双功能催化剂的研究也备受关注。
Huang 等[102]报道了一种盐模板法,在氮掺杂的石墨烯碳载体上负载高载量的单分散钴原子,制得催化剂的钴载量高达15.3%。因此,当该催化剂被用于ZABs 之中时,该电池具有945 W·h·kg−1(以Zn质量计)的高能量密度以及出色的稳定性。如图8(a)~(c)所示,使用制得的SCoNC 作为电催化剂构建ZABs,在294 mA·cm−2 的电流密度下可得到约194 mW·cm−2的峰值功率密度,与基于Pt/C 催化剂相当(在255 mA·cm−2时约为177 mW·cm−2)。Deng 等[107]通过利用调整后的双金属Zn/ Co 沸石咪唑骨架(ZnCo−ZIFs),控制合成了具有不同形貌结构的Co基催化剂。相比于具有颗粒、团簇的Co基催化剂以及贵金属Pt/C+RuO2催化剂,该单原子Co 催化剂也显示出了更为优异的双功能ORR/OER 活性及稳定性。
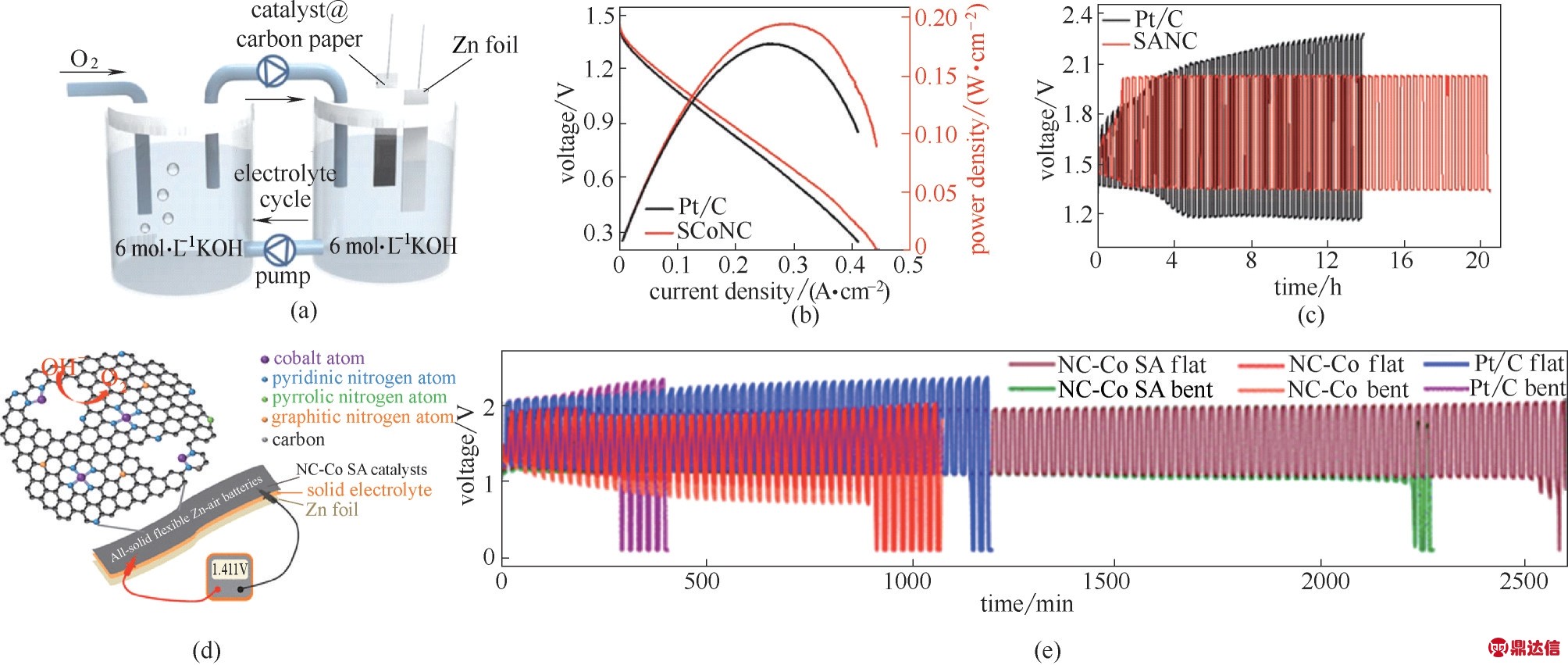
图8 基于SCoNC催化剂的液相锌−空气电池示意图(a),极化和功率密度曲线(b)以及充放电循环性能测试(c)[102];基于CoN4/NG的柔性固态Zn−空气电池示意图(d)以及其充放电循环性能测试图(e)[104]
Fig.8 Schematic diagram of Zn−air battery with 6 mol·L−1 KOH electrolyte(a);polarization and power density curves of primary Zn−air batteries using Pt/C and SCoNC as ORR catalyst(b);discharge/charge cycling curves of two−electrode rechargeable Zn−air batteries using the SCoNC and Pt/C air electrode,respectively(c)[102];Schematic diagram(d)and discharge/charge cycling curves(e)of flexible solid−state rechargeable Zn−air batteries[104]
对使用催化剂组装所得的ZABs,其性能测试大多在6 mol·L−1 KOH 液相体系进行。但是考虑到实际应用,液相体系ZABs 往往难以满足多变的应用场景的不同要求,因此就实际应用而言,固态柔性ZABs 具有更广阔的应用空间和前景[108]。Guan 等[104]开发了锚定在多孔氮掺杂碳纳米薄片阵列中的钴基SACs(NC−Co SA),并首次将该催化剂作为没有任何黏合剂和添加剂的空气阴极应用于水性和固态ZABs。如图8(d)、(e)所示,除优异的储能性能外,该器件还具有出色的循环稳定性和灵活性,并具有很高的开路电位。特别是当其应用于固态柔性ZABs 时,该电池具有非常好的循环稳定性(2500 min,125个循环)以及高开路电位(1.411 V),揭示了该催化剂在固态柔性电池里巨大的应用前景。Cao等[4]以表面活性剂辅助的方法合成的CoN4/NG 催化剂,超电势ΔE 为0.74 V。基于CoN4/NG 的液体和柔性固态ZABs 均表现出出色的放电和充电性能以及良好的稳定性。尤其值得关注的是,基于CoN4/NG的柔性固态ZABs 可提供28 mW·cm−2 的高功率密度,并在30 次折叠循环后依然表现出良好的性能,为取代贵金属(Pt 基,IrO2基)应用于液态和可折叠固态ZABs 中提供了机会。Sun 等[3]开发的Fe−Nx−C催化剂作为柔性全固态ZABs 的氧电极时,该电池显示出1.49 V的高OCV和120 h的长循环寿命。
上述催化剂之所以能够具有非常好的双功能性质,一方面,这些催化剂本身的活性中心就能够催化这两类反应;另一方面,较多的活性中心也非常重要。因此,无论是开发具有更高金属载量的催化剂亦或是优化催化剂结构使更多的活性中心暴露在三相界面之上,其最终目的都是达到充分催化反应从而提高电池性能的效果。此外,一体化无黏结剂的氧电极设计,可以有效地提高电极的力学性能和电子导电性,为ZABs 电池的性能提升也提供了突出的促进作用。因此,构建具有无黏结剂的双功能高载量SACs,在ZABs 的实际应用领域中具有举足轻重的地位。但是,目前的双功能催化剂研究仍离实际应用提出的要求有一定差距。要实现同时高效催化两类催化反应,还需要对催化机理进行深入研究。同时在具有优良催化活性的催化剂的基础之上,如何优化电池结构,改善电池内部能量损失问题,从而实现催化剂的高效使用也是ZABs发展的重要方向。
3 总结与展望
综上所述,作为新兴催化剂的SACs,为电化学反应带来了许多全新的可能性,也为研究人员提供了更多深入理解催化剂反应机理的角度和机遇。对于氧电极反应,SACs 也受到研究者的广泛关注,众多研究人员在该领域进行了许多探索。在本综述中,首先介绍了ORR、OER 两类反应的可能反应机制。随后将催化剂分为三类进行了总结与讨论,分别为ORR SACs、OER SACs 和双功能SACs,并根据构成活性位点的不同金属元素进行了分类阐述,重点关注了催化剂的共性和进展情况。对于这两类氧电极反应,非常多的SACs都被开发利用。而设计用于ORR和OER的SACs共同面临着以下几方面的问题:(1)对于贵金属催化剂而言,如何在降低贵金属用量的情况下,保证贵金属活性中心能够有效地催化反应进行,即需要保证贵金属单原子活性中心能够起到如同在颗粒中的作用。如在ORR 中,单原子Pt 催化剂更容易催化二电子过程,如何保证其能够有效地催化四电子过程是需要去进一步探索的方向。对于OER,单原子Ir或Ru常被锚定在本身就具有OER 催化活性的材料之上。其是作为实际活性中心催化了OER 反应,还是仅仅优化了载体材料的催化性能,这也需要进一步探索。(2)对于非贵金属催化剂,二者都面临着如何进一步提高催化剂性能的困难。首先,二者的活性都还具有较大的发展空间。由于金属原子的负载量小,活动中心的数量也受到限制,因此进一步提高金属原子的负载量成为目前发展SACs 的重点。同时,进一步优化SACs 的几何结构,促使活性中心的利用率最大化,也是进一步提高SACs 催化活性的有效措施。(3)虽然金属单原子与载体之间存在SMSI,但是单原子在使用过程中,特别是在高电位下或强腐蚀性的酸性溶液中,金属单原子是否还能保持足够高的稳定性,也是后续要继续发展研究的方面。(4)目前,SACs的开发大多还是利用试错法进行合成研究,对SACs 活性中心的认识还缺乏深入研究。因此掌握和了解各类型SACs的结构与性能之间的构效关系,以建立能够准确描述该构效关系的描述符,对于进一步指导SACs 的合理设计非常重要。(5)从合成策略方面,目前对于两类反应所使用的催化剂,其均遵循SACs 合成所采用的合成方法。但是如何精确控制催化剂的结构,并实现大规模合成仍然是巨大的难题。
因此,针对以上问题,几个方面的建议被提出:(1)开发更为优异的计算方法以及原位观测手段,研究中间物种在催化剂表面的状态以及催化剂表面活性中心的价态,充分认识这两类反应在催化剂表面的反应机理,为催化剂的结构与性能的构效关系的建立提供基础。(2)开发精准合成SACs 的合成方法学,精确调控催化剂中金属原子的配位环境以及催化剂的几何结构,实现SACs的可控合成。(3)构建SACs模型催化剂,了解催化活性中心本征催化活性,用于指导后续SACs的合成。(4)开发保护或者限域措施进一步提高氧电极SACs 中金属单原子的结构稳定性。(5)不仅需要研究SACs 对氧电极反应的催化效率,还需要进一步研究SACs 催化电极结构,使之能够充分发挥催化作用,最终促使电池展现出优异的性能。
总之,在氧电极反应方面,高性能SACs 的发展仍有很大的空间,这方面的重大突破备受期待。



